Съдържание
В разговорния език често се появяват нови термини, чийто звук за опонента може да изглежда непознат, безсмислен. Не е много удобно да питам отново събеседника, а и не бих искал да демонстрирам публично своята некомпетентност. Затова се препоръчва да изучавате нови думи от разговорната реч, да разберете тяхното значение.
Какво е валидиране
Това е един от тематичните термини, които е трудно да се обясни от обикновен лаик, още по-трудно е да се разбере точното определение на научен език. Първичните източници предоставят интерпретация, която е трудна за възприемане, така че е по-добре да използвате прости, достъпни примери от живота. И така, има концепция за валидиране - какво е това с прости думи? След като проучихме научното обяснение, можем да направим заключение. Тази непозната дума е близка по значение до такова понятие като сертифициране, което означава глобална проверка на продукта според всички параметри, първоначално зададени от клиента.
Например, ако говорим за планински велосипед, това превозно средство се счита за валидирано, ако клиентът го е карал, като същевременно е доволен от скоростта, качеството на извършената работа, функциите, дизайна и други параметри, първоначално определени от проекта. Просто казано, това е контролен тест, така че потребителят може лично да провери резултата, наистина печеливша покупка.
Валидирането в общото гражданско право
Тази дума може да означава правната сила на документ, често срещана в гражданското право. С прости думи това е легализация, приемане като норма, одобрение. Например, документ след изтичане на определения период влиза в сила, става валиден в правната сфера, юриспруденцията. Да, валидирането потвърждава окончателно решениесъдии и обжалването вече не е възможно.
Валидиране в системното програмиране
В тази област значението на думата се свързва с получаване, обработка, проверка и предаване на данни. Валидирането е от значение за всеки потребител на акаунт, тъй като потвърждава и официално доказва правилността на действията. За да разберете какво означава тази дума достъпен език, може да се донесе добър примеротносно удовлетвореността на клиентите:
- Човек, който се занимава с копирайтинг, продава своите статии.
- Преди продажба той проверява данните за грешки и използване на плагиатство различни системив онлайн режим.
- Ако според резултатите статията се оказа уникална и правописът отговаря на изискванията на руския език, публикацията е валидна. Самият акаунт в услугата за проверка се нарича валидатор.

Валидиране на производствения процес
Мислейки за фармацевтичната индустрия или индустрията, лесно е да се види, че думата валидиране означава, че продуктът отговаря на всички изисквания на производителя, за да не се разклати безупречната му репутация на пазара за услуги и стоки. Най-просто казано, компанията носи отговорност за високото качество и коректното производство на продуктите, които трябва да отговарят на посочените стандарти:
- Например освобождаването на автомобил става след проверка на всички компоненти, в съответствие с международните изисквания.
- Валидаторът потвърждава декларираното спецификации, лични данни, а преминатите тестове правят автомобила валиден.
- Купувачът, превозвачът или посредникът, в случай на несъответствие в параметрите, може да предяви рекламация към валидатора. След това се извършва допълнително изпитване на стоките в производството.

Каква е разликата между проверка и валидиране
С прости думи и двата термина имат подобно значение, те са синоними. По тази тема могат да се дадат много прости примери, но все пак има съществена разлика. Ако валидирането е цялостна проверка на стоките, тогава проверката се фокусира повече върху съответствието с технологичния процес, последователното изпълнение на всички етапи на производството. Когато готовият продукт не удовлетворява дадено лице по отношение на параметрите за качество, проверката на думата няма значение за заявената претенция.
Сложността на тълкуването на изискванията на ISO 9001 за "валидиране на специални процеси" е известна на всеки мениджър по качеството, който някога се е сблъсквал с прилагането на този стандарт. Така на практика се оказва, че това е съвсем стандартно изискване, ясно и подробно описано в нормативни документиза фармацевтичната индустрия, за други индустрии е придружено от плашещо количество тълкувания и разяснения. Извадка от ISO 9001, точка 7.5.2: „Една организация трябва да валидира всеки процес за производство на продукт или предоставяне на услуга, чийто краен резултат не може да бъде потвърден (проверен) чрез последващо наблюдение или измерване и следователно чиито недостатъци (т.е. крайният резултат) се разкриват едва след началото на използването на продукт или завършване на предоставянето на услугата ». И съответно в стандарта ISO 9000:2005, в 3-та бележка към дефиницията на термина „процес“ (3.4.1), се посочва, че „Процесът, при който потвърждаването (проверката) на съответствието на крайния продукт не може да бъде извършено своевременно или води до значителни икономически разходи, често се нарича специален“.
За фармацевтичната индустрия определението за специален процес попада изцяло в "технологичния процес", т.е. процес на производство на лекарства. Естествено, предполага се, че лекарството е с високо качество. Какво е качество на лекарството? На първо място, това е негово ефективност, безопасности съответствие на спецификацията(стандарт за качество). Съответствието със спецификацията може да бъде потвърдено чрез контрол на качеството (всъщност проверка), но проблемът е, че контролът е избирателен. Тези. контролните резултати се отнасят за цялата серия въз основа на тестване на проби, които не се продават. А още по-голямо предизвикателство е да се докаже, че извадката е представителна. По-нататък още по-зле. Безопасността и ефикасността на лекарствен продукт се потвърждава (или не се потвърждава) само в процеса на неговото използване - т.е. тогава, когато нещо се промени, вече е невъзможно да се поправи.
Ето защо един от ключови принципи(G ood Manufacturing Practice,) се счита за технологичен процес. Валидирането на процеса е обхванато в отделно приложение, Приложение 15, което е включено през 1987 г. И което е много важно, без резултатите от валидирането пускането в търговската мрежа на лекарствен продукт е невъзможно, по-строго казано, забранено е. поддържа концепцията за GMP в изместването на фокуса от контрола на качеството на готовия продукт към осигуряването на качеството на процеса. В допълнение, процедурите за организиране и провеждане на валидиране отразяват основните принципи на GMP, а именно: внимателно планиране, ясно изпълнение и подробна документация. включва такива важни елементи за GMP като научен подход, основан на оценка на риска за качеството и управление на промените.
Какво е валидиране?
Коренът "валиден" означава подходящ. На руски има няколко думи с този корен, например „инвалид“ - неподходящ, „валиден“ - подходящ. Във фармацевтичната индустрия терминът "валидиране" се тълкува по следния начин: " Процесът на документирани доказателства, че е постигната разумна степен на увереност, че
- Производствен процес,
— Аналитични методи,
- Използваното оборудване
— Производствени системи,
отговарят на настоящите принципи на GMP и изпълняват функционалното си предназначение, т.е. използването им действително дава очакваните резултати».
Всъщност валидирането на технологичния процес е крайната цел, за постигането на която е необходимо последователно валидиране на редица други свързани процеси. В GMP общият термин "валидиране" е разделен на две понятия: "валидиране на процес" и "квалификация на производствени системи". Квалифицирането на производствените системи е част от валидирането на процеса, насочено към документиране на пригодността на оборудването, инженерните системи и набор от помещения, които се използват при производството на лекарствен продукт. Извършва се квалификация, за да се уверим, че производствена системане се отразява на качеството на продукта, както и за това, че ако получим отрицателен резултат при директно валидиране на технологичния процес, това не може да се дължи на повреда в оборудването/системата, а причините трябва да се търсят в технологичния процес. себе си). Логично окачествяването на производствените системи е вид превантивна мярка.

По този начин валидирането на процеса във фармацевтичната индустрия означава:
— Квалификация на чисти помещения
– Квалификация на инженерни системи (подготовка на чист въздух, пречистена вода и вода за инжектиране, сгъстен въздух и др.)
- Квалификация производствено оборудване
– Окачествяване на аналитично оборудване (използвано за контрол на качеството на суровини, полуфабрикати и готови продукти)
— Квалификация на складовите площи (суровини, Завършени продукти)
— Валидиране на компютъризирани системи, включително квалификация на ИТ инфраструктурата
— Валидиране на аналитичните методи
— Валидиране на почистване на помещения, оборудване
— Валидиране на асептични условия
— Валидиране на етапите на технологичния процес
— Валидиране на опаковката
Организация на работите по валидиране
Отговорността за извършване на работа по валидиране обикновено се възлага на отдела за осигуряване на качеството. Да координира дейностите структурни подразделениясъздават се валидационна комисия и групи за валидиране.
Документална поддръжка
Стандартен пакет документи за валидиране:
— Генерален план за валидиране (или общ план за валидиране)
— Досие за валидиране (отделно за всеки обект): спецификация на изискванията на потребителя (URS, спецификация на изискванията на потребителя); Протокол за оценка на риска; Програма (сценарий) на валидационни работи; Протокол/Доклад от работата по валидиране; Програма за (планирано, непланирано) повторно валидиране (повторно валидиране)
Квалификация
За всеки елемент от критичната инфраструктура трябва да се извърши квалификация, която по правило се извършва в четири последователни етапа:
(DQ) потвърждение за годност на проекта(дизайн, проектно решение) на технически средства, инженерни системи и оборудване за предназначението им. Обхват на работа на този етап:
– Описание на системата (функция, параметри на оборудването, специални характеристики)
- Техническа документация ( нормативни изисквания, хардуерна документация)
– Оценка на дизайна (структурни материали, оценка на риска от замърсяване)
— Компоненти/елементи на оборудване/системи
— Анализ на възможни повреди/дефекти
– Анализ на метода на производство (критични параметри на работа при производството на оборудване, изисквания за калибриране)
(IQ)фокусирани върху документирани потвърждениетоДа отида,
Какво технически средства, инженерни системии оборудването са проектирани, оборудвани и монтирани в съответствие с работната документация на проекта и препоръките на производителя. Обхват на работа на този етап:
— Наличие на достатъчна документация
— Наличност на всички артикули в доставката
- Правилен монтаж и връзки
— Съответствие на контактните материали
— Съответствие на измервателните уреди
(OQ)фокусирани върху документирани потвърждениетофактът, че технически средства, инженерни системи и оборудване функционират правилно в целия обявен диапазонексплоатационни характеристики. Обхват на работа на този етап:
— Приемливост на документацията (инструкции за експлоатация, поддръжка);
— Тестове, включващи условие или набор от условия, покриващи горни и долни граници на работните параметри:
- Работа на блокиране / аларми.
По правило след този етап на квалификация обектът се пуска в експлоатация.
Работна квалификация ()извършва се за инженерни системи, които работят непрекъснато, както и за оборудване със сложен контрол. Оперативната квалификация е документирана потвърждениетофактът, че технически средства, инженерни системи и оборудване, когато се използват заедно (или за дълго време), могат надеждно да функционират с получаване на възпроизводими свойства на продукта.
В същото време, ако производствената система е оборудвана с автоматизирана система за наблюдение на параметри или обработка на данни, допълнителен валидиране на компютърна система.
Валидиране на аналитични методи
Всеки аналитичен и микробиологичен метод, който се използва за контрол на качеството на суровини, полуфабрикати или готови продукти, трябва да бъде валидиран. Това означава, че трябва да получим доказателства за пригодността на такава техника за контрол на конкретен продукт и съответно да гарантираме получаването на надеждни резултати. В тази връзка изискванията на GMP са напълно съобразени с изискванията на ISO 17025.
Валидиране на почистване
Процедурите за почистване на оборудването също трябва да бъдат валидирани, преди да започнем да произвеждаме лекарство на това оборудване. На първо място, това валидиране има за цел да получи увереност, че може да се извърши висококачествено почистване след производството на такъв продукт. По същество това е минимизиране на риска от кръстосано замърсяване при преминаване към производство на друг продукт на същото оборудване. Ако върху оборудването останат остатъци от предишния продукт, това няма да бъде открито - тъй като няма аналитичен контролза наличието на такива примеси.
Валидиране на асептични условия
в производството на стерилни лекарстваизползвайки асептични технологии, преди началото на самия технологичен процес е необходимо да се потвърди, че през целия процес на производство на лекарството (т.е. продължителността на процеса) нито един микроорганизъм не влиза в продукта. Валидирането на асептични условия се извършва съгласно сценария на симулация, като се използва хранителна среда.
Валидиране на процеса
И директно, валидирането на всеки от етапите на технологичния процес се извършва на 3 последователни серии, като се вземе предвид "най-лошият случай". И което е много важно, валидирането на технологичния процес се извършва отделно за всеки продукт и неговия заявен размер на партидата. Най-лошият случай е извършването на процеса при такива условия и обстоятелства (за параметри на процеса, режими на работа на оборудването), които имат максимални шансове за причиняване на отхвърляне на процеса или несъответствие на продуктав сравнение с идеалните условия. Логиката е много проста - ако при такива условия получим качествен продукт, то гарантирано ще постигнем качество в зададените граници.
Презаверяване/квалификация
След определени периоди на работа (използване), всеки обект/процес трябва да бъде повторно валидиран. Основната цел на повторното валидиране (revalidation) е да се получи потвърждение, че обектът/процесът продължава да бъде във валидно състояние. Това напълно отразява логиката на GMP: „За да потвърдите качеството на един продукт, не е достатъчно да извършите валидиране в началото на неговия кръговат на животатрябва да се наблюдава и непрекъснато да се подобрява” (вижте графиката по-долу).

Разглеждат се планирана и непланирана презаверка. Планирано - извършва се по график в съответствие с предварително определена честота (обикновено след 12-24 месеца). Непланирана ревалидация - след дълъг престой, когато има тенденция на отклонения или когато се правят промени.
Списъкът е даден в последователността, в която трябва да се извърши работата по валидиране.
13-ти международен проект"Съзвездие на качеството'2012"
Александър В. Александров, Група фирми ВИАЛЕК
Резюмета на доклада
Понятията, които ще анализираме задълбочено, се срещат доста често както в ежедневието, така и в специализираната литература, професионална дейност. Много хора искат да знаят, проверка и валидиране - какво е това с прости думи? Каква е разликата между тези термини? Нека разсъждаваме заедно.
Валидиране и проверка - какво е това с прости думи?
И двете понятия са свързани с тестване на продукт и гарантиране на неговото качество. Ако говорим с прости думи, ще изведем следното:
- Валидирането е гарантирана увереност на производителя, че той е създал продукта според всички необходими стандарти.
- Проверка - помага да се уверите, че продуктът отговаря на всички първоначално посочени изисквания към него.
Казвайки с прости думи, че това е проверка и валидиране, трябва да се съсредоточите върху следните факти:
- За потребителя най-важното е валидирането – увереността, че получава правилния продукт, който отговаря на неговите изисквания.
- За производителя проверката ще бъде по-ценна - потвърждение, че продуктът, който той изпраща за продажба, отговаря на всички необходими стандарти и норми.
Друго значение
Ще анализираме разликата в понятията "проверка" и "валидиране" в тестването. Всъщност като цяло те са свързани с международни изисквания за проверка, приемане на технологии и различни продукти.
Но в същото време думите твърдо навлязоха в живота на интернет потребителите. Например, когато се регистрирате в платежни системи като Qiwi, Yandex.Money, трябва да преминете през процеса на проверка. В този случай това означава удостоверяване на посочените данни за себе си, идентифициране от системата.

И тези, които активно използват социални мрежи("VKontakte", "Odnoklassniki" и т.н.), рано или късно виждат прозорец пред себе си с молба да преминат проверката. Това е същата проверка на верността на въведените от вас данни. Например телефонът, свързан с акаунта, получава SMS с код, който трябва да въведете в определено поле, за да потвърдите, че сте собственик на посочения номер.
По този начин в този случай е трудно да се разграничи разликата между валидиране и проверка. И двете всъщност тук е проверка за индикация на данните, отговарящи на реалността. Също така бихме искали да отбележим факта, че разработчиците на различни вируси успешно използват валидиране/проверка, за да примамят вашата лична информация. Защо такива данни трябва да се въвеждат на надеждни ресурси, от компютър, защитен със съвременна висококачествена антивирусна програма.
Дефиниция на ISO 9000:2000
За да обясним с прости думи, че това е проверка и валидиране, описанието на тези термини, дадено в документите на ISO (ISO - Международна организация за стандартизация), ще помогне. Тук виждаме следното:
- Проверката е потвърждение, въз основа на предоставени обективни факти, че установените норми са спазени.
- Валидирането е потвърждение, въз основа на предоставени обективни факти, че установените стандарти за конкретно приложение са изпълнени.

От тези дефиниции разликата между валидиране и проверка вече следва:
- Първата процедура се извършва само при необходимост. Продуктът се анализира при определени работни условия. Резултатът ще бъде присъда: възможно ли е да се използва в тази среда.
- Втората процедура е почти задължителна. Това е тест за съответствие на продукта с изискванията, които ще бъдат приложими при всякакви условия, за всяка употреба.
Други определения за проверка
За да ни помогнат да разберем темата, ще ни помогнат редица общи дефиниции на разглежданите понятия. Ето характеристиките на проверката:
- Потвърждение за съответствие на освободените стоки, продукти с определени стандарти.
- Практически задължителна процедура; сравнение на характеристиките на произведената единица с набор от определени изисквания. Резултатът е присъда за съответствие или несъответствие с последното.
- Обявяване на потвърждение, че са спазени установените норми по отношение на продукта.
- С прости думи, създаден е продукт, който отговаря на необходимите стандарти.

Други определения за валидиране
Помислете сега за дефинициите на валидиране:
- Практическото определяне на това как даден продукт отговаря на очакванията на своите преки потребители.
- процедура, която да се извърши при необходимост. Това е общ анализ на дадени условия и оценка на работата на даден продукт във връзка с работата му в дадена среда. Резултатът е заключение за възможността за използване на продукта, изобретението в определена област.
- Потвърждение за съответствие с изискванията на системата от стандарти, клиента, директния потребител и др.
- С прости думи, създаден е правилният продукт, който удовлетворява потребителя.
Разлики, базирани на превод
За да се определи разликата между валидиране и проверка, позоваването на превода на тези думи, които имат английски корени, също ще помогне:

- Проверка - всякаква проверка.
- Валидиране - придаване на нещо юридическа сила.
Дори от това следва, че проверката предхожда валидирането, не е окончателна. Именно последният дава окончателната присъда на продукта, която има юридическа сила.
Разлики между проверка и валидиране в сравнение
AT сравнителна таблицапо-лесно е да се идентифицират разликите между тези донякъде сходни термини.
| Проверка | Валидиране |
| Правилно ли правим продукти? | Произвели ли сме правилния продукт? |
| Внедрена ли е цялата функционалност? | Правилно ли е внедрена функционалността? |
| Проверката предхожда валидирането: тя включва пълна проверка на коректността на писане, производство и друго създаване. | Това става след проверка - качеството на произведения продукт. |
| Провежда се от разработчици. | Провежда се от тестери. |
| Статистически тип анализ: сравнение с установени изисквания към продукта. | Динамичен тип анализ: продуктът се тества в експлоатация, за да се определи съответствието му с нормите. |
| Обективна оценка: базирана на съответствие с определени стандарти. | Субективна оценка: лична оценка, дадена от тестиращ. |
Нека поговорим малко повече за разликата между валидиране и проверка в следващия раздел.
Ключови разлики между понятията
И така, нека сложим точката на i. Проверката е всяко тестване, през което преминава даден продукт. Проверка на правилността на технологията на неговото производство, както и качеството на продукта. Валидирането е концепция, по-близка до сертифицирането. Това съответствие с някои конкретни, а не Общи изисквания. Колко добър е продуктът не като цяло, а конкретно за конкретен потребител, клиент или дадени условия.
Може също да се отбележи, че проверката е хартия, теоретично тестване на технология или продукт. Валидирането е реална, физическа проверка, извършена на практика, в специфични условия.

Ако продуктът е преминал проверка, това означава, че отговаря на някои изисквания технологични изисквания. При успешно преминаване на валидирането се оказва, че и на практика е приложимо без оплаквания. От това можем да заключим, че последното понятие е малко по-важно, по-показателно от първото.
Примери за проверка
Нека разгледаме конкретни примери, за да подсилим разликата между тези понятия.
Фармацевтичната фабрика проверява лекарствата за съответствие със специфични изисквания. В началото на производството се установява тяхната безопасност за пациента в определени дози, липсата на плацебо ефект, липсата на възможност за разрушително пристрастяване и т.н. Така проверката на лекарството е преминала. И валидирането в този случай вече се извършва от лекуващия лекар: той определя дали лекарството ще помогне на конкретен пациент, дали употребата му ще доведе до риск за живота и здравето на този човек и т.н.
Да вземем за пример един велосипед. Проверяваме дали има волан, седалка, вериги, колела, спирачна система и др. Всичко на място ли е? Проверката премина!
Примери за валидиране
Сега примери за това как валидирането се различава от верификацията.

Всяко предприятие, в съответствие с определени изисквания, произвежда универсални тръби. Въпрос идва от клиента: възможно ли е този продукт да се постави на дъното на морето? Производителят трябва да валидира своите тръби според предложените условия, за да отговори обективно на този въпрос.
На примера на същия велосипед също е много лесно да се разгледа валидирането. Може ли устройството да се кара? Можете ли да забавите? Можеш ли да завиеш надясно или наляво? Превключване на скоростта? Ако всичко е възможно, валидирането е преминало. Не успяхме да намалим, седалката падна, воланът се разхлаби - уви, моторът не мина през тази процедура.
Така че ние подредихме понятията "проверка" и "валидиране", опитвайки се да изразим всичко на прост език. Надяваме се, че това ще ви помогне ясно да проследите разликата между тях, характеристиките на всеки.
- (12.10) Производителят трябва да документира цялостната политика за валидиране, целите и принципите, включително валидирането. технологични процеси, процедури за почистване, аналитични процедури, процедури за контрол в процеса, компютъризирани системи и във връзка с лицата, отговорни за разработването, проверката, одобрението и документираневсяка стъпка от валидирането.
- (12.11) Критичните параметри и/или характеристики обикновено трябва да се определят на етапа на проектиране или въз основа на предишен опит; диапазоните на стойностите на тези критични параметри и (или) характеристики, необходими за осигуряване на възпроизводимостта на процеса, също трябва да бъдат определени. В този случай е необходимо:
- определят критичните характеристики на API като продукт;
- посочете параметрите на процеса, които могат да повлияят на критичните показатели за качество на API;
- задайте диапазона от стойности за всеки критичен параметър на процеса, който да се използва при серийно производство и контрол на процеса.
- (12.12) Операциите, които се считат за критични за качеството и чистотата на API, трябва да бъдат валидирани.
Документация за валидиране (12.2)
- (12.20) За всеки процес, който трябва да бъде валидиран, следва да се разработи протокол за валидиране. Този протокол трябва да бъде прегледан и одобрен от звеното(ата) по качеството и други съответни звена.
- (12.21) Протоколът за валидиране трябва да дефинира критичните стъпки на процеса и критериите за приемане, както и типа валидиране, което трябва да се извърши (напр. ретроспективно, проспективно, едновременно) и броя на производствените серии.
- (12.22) Докладът за валидиране трябва да направи кръстосана препратка към протокола за валидиране и да обобщи констатациите, да обясни всички открити отклонения с подходящи заключения, включително препоръчани промени за коригиране на недостатъците.
- (12.23) Всички отклонения от протокола за валидиране трябва да бъдат документирани с подходяща обосновка.
- (12.30) Преди започване на работата по валидиране на процеса, квалификацията на критично оборудване и спомагателни системи. Квалификацията обикновено се извършва на следните етапи (индивидуално или в комбинация):
- квалификация на проекта: документирано доказателство, че предложеният проект на инсталация, оборудване или система е годен за предназначението си.
- квалификация за инсталиране: документирано потвърждение, че инсталирането на помещения, системи и оборудване (инсталирано или модифицирано) е извършено в съответствие с одобрения проект, препоръките на производителя и (или) изискванията на производителя на лекарството.
- квалификация за изпълнение: документирано доказателство, че съоръженията, системите и оборудването (независимо дали са инсталирани или модифицирани) функционират по предназначение при всички предвидени режими на работа.
- Квалификация за изпълнение: Документирано доказателство, че съоръженията, системите и оборудването, когато се използват заедно, работят ефективно и възпроизводимо в съответствие с определени изисквания и характеристики на процеса.
Подходи за валидиране на процеса (12.4)
- а) (1) определени са критични показатели за качество и критични параметри на процеса;
- б) (2) установени са подходящи критерии за приемане и контрол в процеса;
- в) (3) не е имало значителни повреди в процеса или дефекти на продукта поради причини, различни от грешка на оператора или повреда на оборудването;
- г) (4) профилите на примесите са установени за този API.
- (12.45) Партидите, избрани за ретроспективно валидиране, трябва да представляват представителна извадка от всички партиди, произведени през разглеждания период, включително всички партиди, които не отговарят на спецификациите. В този случай броят на такива серии трябва да е достатъчен, за да докаже постоянството на процеса. Архивни проби могат да бъдат тествани, за да предоставят данни за ретроспективно валидиране на процеса.
Програма за валидиране на процеса (12.5)
- (12.50) Броят на производствените серии, необходими за валидиране, трябва да зависи от сложността на процеса или значимостта на промените в процеса, които трябва да бъдат взети предвид. За проспективно и едновременно валидиране трябва да се използват данни, получени от три последователни производствени партиди продукти. добро качество. Възможно е обаче да има ситуации, когато са необходими допълнителни данни за доказване на стабилността на процеса. производствени цикли(напр. сложни производствени процеси на API или продължителни производствени процеси на API). За да се оцени последователността на процеса при ретроспективно валидиране, като правило е необходимо да се изследват данни за 10 - 30 последователни серии, но с подходяща обосновка този брой може да бъде намален.
- (12.51) По време на проучванията за валидиране на процеса трябва да се наблюдават и проверяват критичните параметри на процеса. Параметри на процеса, които не са свързани с качеството, като променливи, контролирани за намаляване на консумацията на енергия или използването на оборудване, могат да бъдат пропуснати от валидирането на процеса.
- (12.52) Валидирането на процеса трябва да потвърди, че профилът на примеси за всеки API е в определени граници. Профилът на примесите трябва да бъде подобен (или по-добър от) на предишния профил, а също и (където е приложимо) профила на примеси, установен по време на разработването на процеса или партидите, използвани за основни клинични и токсикологични изследвания.
Периодичен преглед на валидирани системи (12.6)
- (12.60) Системите и процесите трябва да бъдат обект на периодична оценка, за да се потвърди, че продължават да функционират правилно. Ако процесът или системата не са въведени значителни промении прегледът на качеството потвърди, че системата или процесът постоянно произвежда материал, който отговаря на спецификациите, обикновено без необходимост от повторно валидиране.
- (12.70) Процедурите за почистване обикновено трябва да бъдат валидирани. Валидирането на пречистване се извършва в случаите, когато замърсяването или прехвърлянето на вещества представлява най-голям риск за качеството на API. Например, може да не е необходимо процедурите за почистване на оборудването да бъдат валидирани в началото на процеса, ако остатъците се отстранят в следващите стъпки на почистване.
- (12.71) Валидирането на процедурите за почистване трябва да отразява действителното използване на оборудването. Ако различни API или различни междинни продукти се произвеждат в едно и също оборудване и оборудването се пречиства по същия метод, тогава представителни междинни продукти или API могат да бъдат избрани за валидиране на пречистването. Такъв избор трябва да се основава на данните за разтворимостта и трудностите при пречистване, както и на изчисляването на границите на остатъчните вещества, като се вземат предвид тяхната активност, токсичност и стабилност.
- (12.72) Протоколът за валидиране на почистването трябва да описва оборудването, което ще се почиства, процедурите, материалите, приемливите нива на почистване, контролираните и контролираните параметри и аналитичните методи. В протокола трябва да се посочат и видовете взети проби, методите за техния подбор и етикетиране.
- (12.73) За откриването както на неразтворими, така и на разтворими остатъци, методите за вземане на проби трябва да включват, според случая, тампони, тампони или други методи (напр. директна екстракция). Използваните методи за вземане на проби трябва да могат да определят количествено нивата на остатъци върху повърхностите на оборудването след почистване. Методът за вземане на проби може да не е практичен, ако контактните повърхности на продукта са труднодостъпни поради характеристики на дизайнаоборудване (напр. вътрешни повърхности на маркучи, транспортни тръбопроводи, реакторни съдове с тесни люкове и малко сложно оборудване като микронизатори и микронебулизатори) и/или където има ограничения на процеса (напр. работа с токсични вещества).
- (12.74) Трябва да се използват валидирани аналитични методи, които са достатъчно чувствителни за откриване на остатъци или замърсители. Границата на откриване на всяка аналитична процедура трябва да бъде достатъчна за откриване на определено приемливо ниво на остатъчно вещество или замърсител. За метода е необходимо да се установи постигнатото ниво на извличане на веществото. Границите на остатъчните вещества трябва да бъдат реалистични, постижими, проверими и базирани на съдържанието на най-вредните остатъчни вещества. Ограниченията могат да бъдат определени въз основа на минималното количество известна фармакологична, токсикологична или физиологична активност на API или неговия най-вреден компонент.
- (12.75) За процеси, при които има необходимост от намаляване на общия брой микроорганизми или ендотоксини в API, или за други процеси, при които такова замърсяване може да предизвика безпокойство (напр. производство на нестерилни API, използвани в производството на стерилни лекарствени продукти ), проучвания за пречистване и/или ) дезинфекция на оборудването трябва да се извършват във връзка със замърсяване от микроорганизми и ендотоксини.
- (12.76) Производителят следва да наблюдава процедурите за почистване на определени интервали след валидиране, за да гарантира, че тези процедури са ефективни, когато се използват в текущия производствен процес. Чистотата на оборудването, когато е възможно, трябва да се наблюдава чрез аналитични тестове и визуална проверка. Визуалната проверка може да открие значителни концентрации на замърсители в малки зони, които иначе не могат да бъдат открити чрез вземане на проби и/или анализ.
Валидиране на аналитични методи (12.8)
- (12.80) Използваните аналитични методи следва да бъдат валидирани. Пригодността на всички използвани методи за изпитване обаче трябва да бъде проверена при действителни условия на употреба и резултатите да бъдат документирани.
- (12.81) Валидирането на метода трябва да се извършва, като се вземат предвид характеристиките, дадени в насоките за валидиране на аналитичните методи. Степента на извършеното аналитично валидиране трябва да зависи от целта на анализа и етапа на производствения процес на API.
- (12.82) Преди валидирането на аналитичните процедури следва да се извърши подходяща квалификация на аналитичното оборудване.
539. (12.83) Трябва да се съхраняват пълни записи за всички промени на валидиран аналитичен метод. Такива записи трябва да отразяват причината за промяната и съответните данни, за да покажат, че промяната дава резултати, които са толкова точни и надеждни, колкото тези, получени с помощта на приетата методология.
Как да валидираме производствените процеси и колко е важно да разграничаваме „специалните“ от тях?
Качалов В.А.
сп. "Методи за управление на качеството", 2010, № 10-11
Изтегляне (размер: 380,3 Kb, изтегляния: 2724 )
Тази публикация е още един опит за отговор.
на "трудните" въпроси на един педантичен мениджър по качеството
Тази статия ще се фокусира върху това как да се тълкуват изискванията на клауза 7.5.2 от стандарта ISO 9001:2008.
Авторът анализира 100 последователни ръководства за качество на компании, сертифицирани в TUV International Certification, както и няколко компании, сертифицирани в други системи за сертифициране, и установи следното.
В 57% от случаите е посочено, че изискванията на клауза 7.5.2 не се прилагат, тъй като компанията няма производствени и сервизни процеси, чиито резултати не могат да бъдат проверени чрез последващ мониторинг или измервания 1.
Тези компании извършват добив и преработка на руда и въглища, производство на метални, парфюмерийни и козметични продукти, обогатяване на уран, транспортиране на газ, основен ремонт на кладенци, управление на радиоактивни отпадъци, архитектурно проектиране, производство на стъклени и пластмасови изделия, предоставяне на услуги за техническа диагностика, обслужване на пътници, производство на строителни конструкции, хранителни продукти, както и диспечерство и електроснабдяване, машиностроене, уредостроене, производство на каучукови изделия, СМР.
В останалите 43% от случаите беше посочено, че горните процеси са налице и че са валидирани в съответствие с изискванията на точка 7.5.2. Това включваше представители на петрогеофизиката, електротехниката, автомобилостроенето, производството на тръби, както и диспечерство и електроснабдяване, машиностроене, уредостроене, производство на каучукови изделия и СМР.
По този начин можем да кажем с голяма увереност, че изискванията на клауза 7.5.2 на стандарта ISO 9001:2008 се прилагат от 40 до 50% от сертифицираните компании, което означава, че в Русия говорим за много хиляди, ако не и десетки хиляди такива компании.
Анализът обаче показва следното:
Първо. Представители на една и съща индустрия (те са подчертани с удебелен шрифт по-горе), използвайки почти същите технологии, въпреки това оценяват по различен начин наличието на процеси, които изискват прилагането на изискванията на точка 7.5.2.
Второ. Много организации прилагат „собствена“ интерпретация на съдържанието и значението на дейностите по валидиране на процеса, включително тези, изисквани от стандарта демонстриране на способността на процесите да постигатпланирани резултати,например:
Компанията е определила производствените процеси като специални процеси, резултатите от които не могат да бъдат проверени чрез последователно наблюдение или измерване. СПОСОБНОСТТА на тези процеси за постигане на планираните резултати СЕ ПОТВЪРЖДАВА ЧРЕЗ използването на подходящо оборудване и квалификация на персонала, прилагането на специфични методи и процедури и поддържането на подходящи записи..
Валидиране на основните процеси... ОСИГУРЯВА СЕ С ЛИЦЕНЗ образователни дейности, удостоверение за атестация образователна институция, сертификати за държавна акредитация 2 .
В Наръчника за качество на един организация на строителствоторазделът "Валидиране на производствени и сервизни процеси" съдържа 8 подраздела, но цитирането им няма смисъл, тъй като всъщност нито един от тях няма нищо общо с дейностите по валидиране на процеси.
трето. Обясненията на изискванията на точка 7.5.2 от ISO 9001:2008 в специализираната литература са изключително кратки и не винаги ясни. Ето, например, ПЪЛНИЯТ текст на коментарите към този раздел в:
Изискванията на тази подточка се прилагат, когато не е възможно да се измерват параметри и да се наблюдават процеси в съответствие с подточка 8.2.3 "Мониторинг и измерване на процеси".
Тази подточка на стандарта се прилага за ситуации, при които не е възможно да се оцени резултатът от процеса или ако такава оценка може да бъде получена само след дълго време.
Отговорност на организацията е да оцени предварително вероятността от възникване на такива ситуации и да има подходящ контрол за такива процеси.
Не Допълнителна информацияпо този въпрос няма да намерим дори в голяма монография. Коментирайки обсъжданите изисквания, неговият автор просто преразказва съответните изисквания на стандарта ISO 9001 в много съкратен вариант.
Ако говорим за целенасочени изследвания, например за публикуване, тогава, както ще бъде показано по-долу, те съдържат много противоречиви твърдения.
Четвърто. Изискванията за валидиране на производствени и сервизни процеси не се съдържат само в стандарта ISO 9001:2008. Те също са включени в съдържанието:
Други международни стандарти, базирани на изискванията на ISO 9001, като ISO/TS 16949:2009 и ISO/TS 29001:2003;
Споразумения, разработени по време на международни семинари (International Workshop Agreement - IWA), например IWA 2:2003 и IWA 4:2005;
международни стандартипубликувани от други международни асоциации, като IRIS.
Всички тези обстоятелства потвърждават уместността на търсенето на отговори на въпросите, поставени в заглавието на статията.
1. Как да валидираме производствените процеси
1.1. Изисквания на клауза 7.5.2 на ISO9001:2008 и „специални процеси“
На практика цялото обсъждане на изискванията на точка 7.5.2 обикновено е свързано с концепцията за специални процеси, въпреки че в нейния текст няма директни препратки към тези процеси. Освен това в този раздел на ISO 9001:2008 и в ISO 9000:2005, където е дадено понятието „специален процес“, те казват, на пръв поглед, че не е точно едно и също нещо:
ISO 9001:2008 се отнася до процесите чиито резултати НЕ МОГАТ да бъдат проверени чрез последващ мониторинг или измервания;
ISO 9000:2005 се отнася до процесите при които проверката на съответствието на получения продукт е ТРУДНА или ИКОНОМИЧЕСКИ НЕРАЗУМНА.
и "не мога" „трудно или не икономическицелесъобразно"като различни неща.
Всъщност и двата източника казват, разбира се, едно и също нещо. Първо, защото „трудно или икономически неосъществимо“, включително техния краен случай „не е възможно при настоящите условия“, представляват изчерпателен списък от причини защо „не може“.
Второ (и това е основното), както в първия, така и във втория случай на процеси проверката на техните резултати НЕ СЕ ПЛАНИРА и НЕ СЕ ИЗВЪРШВА. И ето защо недостатъци в продукт или услугане могат да бъдат идентифицирани по време или след създаването им, и стават забележими едва след като продуктът е бил използван или услугата е била предоставена.
Извод едно. Изискванията на точка 7.5.2 се прилагат само за тези ПРОИЗВОДСТВЕНИ ПРОЦЕСИ, които в съответствие с терминологията на стандарта ISO9000:2005 са категоризирани като "специални". Строго погледнато, изискванията на този раздел нямат нищо общо с други процеси.
Основната характеристика на специалните процеси е, че когато се ПРИЛАГАТ, получените резултати по една или друга причина НЕ ПОДЛЕЖАТ на проверка. Това ПО ПРИНЦИП ИЗКЛЮЧВА възможността за потвърждаване или непотвърждаване на съответствието на тези резултати с изискванията, които се позовават на тяхната конкретна предпоставка моята употреба или приложение,ПРЕДИ да започнатизползване или приложение.
Като се има предвид това, става ясна важността на изискването на ISO 9001:2008 всеки специален процес да бъде валидиран предварително, а именно преди прилагането му.
1.2. Съдържание и цел на валидирането на производствените процеси
За съжаление, прилагането на термина „валидиране“ към процеси, както е дефинирано в ISO 9000:2005, а именно: потвърждение (чрез предоставяне на обективни доказателства), че са изпълнени изискванията, свързани с конкретна предвидена употреба или приложение,- причинява доста определени трудности. За да помогнат за преодоляването на тази трудност, публикациите се опитват да дефинират същността на валидирането на процеса 3 , включително как да:
валидиране, одобрение, легализация, ратификация [ 15];
процедура, която дава висока степенувереност, че конкретен процес, метод или система ще дава последователно резултати, които отговарят на предварително определени критерии за приемане;
(от лат. valius - силен, здрав, съответстващ на здрав) - документирано действие потвърждаване, че методите, процесите, дейностите или системите, използвани в изследванията или производството, действително водят до очакваните резултати в съответствие с регулаторната документация;
получаване на документирани доказателства, които дават висока степен на увереност, че процесът постоянно ще произвежда продукт, който отговаря на предварително определени изисквания и критерии за качество;
доказателство, че нещо (процес и т.н.) работи както трябва. С други думи, процесът трябва да работи в съответствие с целта си. За да се докаже, че това е така, се използва система от последователно извършвани проверки и тестове, наречена валидиране..
Горните определения помагат да се разбере, че валидирането на процес означава извършване на контролни действия, за да се установи дали процесът, разработен „на хартия“, има следното присъщо свойство: когато се прилага в строго съответствие с разработената технология, той ви позволява да получите резултати които отговарят на изискванията за техните конкретна предназначена употреба или приложение.Ако се получи определеното доказателство за съответствие, процесът се признава за валидиран.
Второ заключение. СЪДЪРЖАНИЕТО на дейността по валидиране на процеса е дейността по оценяване на съответствието на неговите изходи с изискванията за тяхната конкретна предвидена употреба или приложение, а ЦЕЛТА на валидирането е да придобие увереност, че процесът има устойчива присъща способност да постигне това съответствие, когато прилагани в бъдеще.
1.3. Валидиране на производствени процеси и валидиране на продукти
Валидирането на процеса изисква действия за оценка на съответствието на неговите резултати (произведени продукти или полуготови продукти) с определени изисквания. И това, на езика на стандарта ISO 9000:2005, е дейност по проверка. В същото време е лесно да се забележи: ако по време на ПРОВЕРКАТА на произведените продукти в състава установени изискванияще бъдат включени изисквания, свързани с конкретна предвидена употреба или приложение,тогава такава проверка автоматично се превръща във ВАЛИДАЦИЯ на продукта.
Това означава, че: когато критериите за приемане на продукти, произведени чрез процес (включително междинни), включват изисквания, свързани с неговата специфична предназначена употреба или приложение,и след завършване на процеса, произведеният продукт МОЖЕ и ТРЯБВА да бъде проверен спрямо такива критерии за приемане, тогава положителните резултати от тази проверка едновременно ще бъдат доказателство за валидирането както на самия продукт, така и на неговия производствен процес. Нещо повече, именно на този принцип е изграден масово използваният механизъм за разпознаване, одобрение и т.н. (в крайна сметка валидиране) на производствените процеси - върху валидирането на продуктите, произведени с тяхна помощ 4 .
Друго нещо е, ако получените продукти по една или друга причина НЕ МОГАТ да бъдат подложени на процедурата за проверка. Как да бъдем в този случай? Това наистина е въпрос, при това най-важен за тази част от статията. Това е, което ще бъде обсъдено по-долу.
Заключение третото. Положителните резултати от валидирането на продукта са пряко доказателство за валидирането (основната приемливост за неговото приложение) на неговия производствен процес, тъй като по този начин те демонстрират, че този процес има вътрешна способност да получава това, което се изисква от него.
1.4. Валидиране на конкретен процес и оторизация за конкретното му приложение
За последващото му ПРИЛОЖЕНИЕ се разработва специален процес, както всеки друг. Едва ли обаче е препоръчително да се пристъпва към изпълнението му, ако няма ДВЕ последователно получени разрешения за ползване – основно и частно. Това сочи съдържанието на точка 7.5.2.
1.4.1. Основно разрешение за използване
Това се изисква от първия параграф на този раздел на стандарта, който се отнася до необходимостта от валидиране на специални процеси. Нека обясним значението на това твърдение.
Валидирането, както бе споменато по-горе, потвърждава, че процесът има ВЪТРЕШЕН КАПАЦИТЕТ за постигане на желаните резултати. Това потвърждение обаче трябва да се основава на демонстриране на способността на процеса да постига планирани резултати,базиран на установени критерии.Следователно авторът споделя гледната точка на тези, които твърдят, че валидирането на процеса е основанието за неговото ОФИЦИАЛНО одобрение.
В същото време е изключително важно да се разбере КАКВО ТОЧНО се случва по време на валидирането на производствения процес.
Придобиването на този статус е възможно само когато по време на изпълнението на този процес:
а) ИЗПЪЛНИТЕЛИ на работа, чиято компетентност не е по-ниска от изискванията, установени в описанието на разработения процес,
б) използване на ОБОРУДВАНЕ с характеристики не по-лоши от тези, установени в описанието на разработения процес,
в) от СУРОВИНИ, МАТЕРИАЛИ, КОМПОНЕНТИ, имащи характеристики не по-лоши от установените в описанието на разработения процес,
d) в РАБОТНА СРЕДА, която не е по-лоша от описаната в описанието на процеса на проектиране, и
д) в строго съответствие с ТЕХНОЛОГИЧНИТЕ ХАРАКТЕРИСТИКИ НА ОПЕРАЦИИТЕ (температура, ток, химичен състави др.), които са установени в описанието на разработения процес ПОЛУЧЕНИ СА ПРОДУКТИ (включително междинни), които отговарят на изискванията, че се отнасят до неговата конкретна предназначена употреба или приложение.С други думи, поне веднъж в ТАКИВА условия на прилагането му, процесът наистина е дал "на изход" това, което се иска от него.
Прилагането на „валидиран“, „оторизиран“, „атестиран“ или „одобрен“ към процеса означава, че, както е подадено от разработчиците, той е преминал поне веднъж процедурата за валидиране с положителни резултати, на тази база е официално признат като приемливи и одобрени за бъдеща употреба. Валидирането сигнализира, че даден процес има основно (първоначално, основно) разрешение за използванеили разрешение за използване на процеса като такъв 5 . ПРИНЦИПНО е готов за употреба.
Но ще забележим особено И САМО.
1.4.2. Лично разрешение за използване
Само по себе си конкретното „пускане в производство“ на специален процес, дори и валидиран, по никакъв начин не означава, че ще получим това, което сме искали след неговото завършване.
При нужда с голям дялувереност да получи от прилагането на валидирания процес същите резултати, на които той е потенциално способен и които е „издал” по време на валидирането си, е необходимо във ВСЕКИ случай да се осигури наличието на такива условия за неговото прилагане, които да НЕ ПО-ЛОШИ от тези, които бяха по време на валидирането му. А именно: да гарантира, че компетентността на участниците в работата, използваното оборудване, суровините, материалите, компонентите, производствената среда и технологичните параметри на извършваните операции отговарят на изискванията, установени в документацията на валидирания процес. В теорията за управление на качеството тези компоненти са известни като петте „М“ (човек, механизъм или машина, материал, среда, метод).
Касова бележка частен лиценз за използванеи означава, че валидираният процес разполага с всички необходими "М" на разположение и по този начин е ГОТОВ да започне своето конкретно (отделно взето, частно) изпълнение с ДОСТАТЪЧНА увереност в положителен резултат.
Точно това е посочено в третия параграф на клауза 7.5.2, който изисква организацията:
одобрен (признат приемливостта) на оборудването,които планират да използват в този процес, и квалификация на персонала,кой ще участва в изпълнението на този процес;
приложени специфични (предназначени специално за този процес) методи и процедури,т.е. точно тези, които са валидирани и имат основно разрешение за използване;
Създадени записи, потвърждаващи наличието както на първоначални (валидирана технология, приемливо оборудване, персонал, суровини, материали и компоненти), така и на поддържащи компоненти на процеса (съответствие с технологията и изискванията за производствената среда 6).
Важно е да се подчертае, че частен лиценз за използванее НЕЗАВИСИМО одобрение, необходимо за КОНКРЕТНО приложение на процеса. Той не само не отменя, но ПРЕДПОЛАГА съществуването на валидиран процес като цяло. В същото време анализът на Насоките за качество показа, че разликата между основното и частното разрешение за ползване се признава и взема предвид далеч не от всички.
Например, един от наръчниците за качество гласи: СПОСОБНОСТТА на тези процеси за постигане на планираните резултати се потвърждава ЧРЕЗ ПРИЛОЖЕНИЕТО НА ПОДХОДЯЩОТО ОБОРУДВАНЕи квалификация на персонала, прилагане на специфични методии процедури и поддържане на съответните записи.
Това казва друг ВАЛИДИРАНЕТО на специални процеси ВКЛЮЧВА:
сертифициране на използваното оборудване;
проучване на използваните материали;
обучение и сертифициране на персонала.
В третото това КРИТЕРИИ ЗА ОДОБРЕНИЕ[в смисъл на валидиране - прибл. изд. ] процес СА:
резултати от атестирането на персонала;
резултати от сертифицирането на оборудването;
изпълнение на графика за контрол на технологичната дисциплина и резултатите от него.
Както можете да видите, в тези случаи, когато говорим за действията за извършване на валидирането на процеса, т.е. основно разрешение за използване,организациите всъщност инвестират в тях смисъла на действията за получаване
Заключение четвърто.Изразът "валидиран процес", разбира се, означава, че този процес е "одобрен", "сертифициран", "оторизиран / разрешен за употреба" и т.н., тъй като е демонстрирал поне веднъж съответствие с КРИТЕРИИТЕ ЗА ВАЛИДАЦИЯ - способността им да постигат планираните резултати.Но това е само изявление на процеса „по принцип“, което означава, че той има „ОСНОВНО разрешение за използване“.
За да успеете в КОНКРЕТНО приложение на валидиран процес, е необходимо също така да се гарантира, че има и „ЧАСТНО разрешение за приложение“. Основата за получаването му ще бъде съответствието на процеса с ДРУГИ КРИТЕРИИ, а именно: осигуряване на увереност, че този процес, в това конкретно приложение, ще се проведе при същите условия, както по време на неговото валидиране.
За да се гарантира изпълнението на всяка конкретна поръчка, използваните специални процеси трябва да имат И ДВЕТЕ посочени одобрения за приложение.
1.5. Грешки при разпознаването на специални процеси като валидирани
Анализът на наръчниците за качество и публикациите показа, че в много случаи валидирането на специални производствени процеси, изисквани в точка 7.5.2, т.е. основно разрешение за използване,доброволно или неволно, но бива ЗАМЕСТЕНО или дори ЗАМЕСТЕНО чрез получаване частен лиценз за използване.Типичен пример за това е методологията за валидиране на процеса на една от организациите, описани в публикацията.
В него разумно се посочва, че са необходими критерии/изисквания за валидиране/валидиране на конкретен процес и че 10 дни преди датата на валидиране се изготвят протоколи за потвърждаване на съответствието на факторите с установените изисквания, въз основа на които комисията взема решение за одобрение на специален процес или за необходимостта от неговото повторно валидиране.
И всичко би било наред, но оценяваните фактори тук не бяха характеристиките на избрания продукт (но организацията предоставя комуникационни услуги), а не степента на съответствие с техните изисквания, свързани с конкретна предназначена употреба или приложение. Анализираните фактори бяха: оборудване, персонал, техника, софтуер, работна среда и ресурси. И проверенисъобразени са с установеното В ПРОЦЕДУРИТЕ за предоставяне на съобщителни услуги. А това означава, че РЕАЛНО са предприети действия за получаване не на основно, а на частно разрешение за ползване.
Ето защо, ако стриктно следвате методологията, описана в методологията, тогава решението, взето в тази организация nie при одобрение на специалния процес(т.е.решение за валидиране на процеса) всъщност няма нищо общо с ВАЛИДАЦИЯТА, тъй като се основава единствено на оценка на съответствието на определено „М“ с изискванията, установени в описанието на процеса, а не на оценка на съответствието на РЕЗУЛТАТИТЕ от процеса с изискванията за тези резултати. Но дали съответните ПРОЦЕДУРИ (т.е. СЪДЪРЖАНИЕТО) на процеса са валидирани и по какъв начин – тези въпроси останаха без отговор в тази публикация.
Пети извод. Не е необичайно организациите да валидират процес, наречен специален, изискващ доказателства за съответствие с неговите резултати. изисквания, свързани с конкретна предвидена употреба или приложение,се заменят с действия за получаване на доказателства за изпълнението на изискванията, УСТАНОВЕНИ от разработчиците на този процес за изпълнители, суровини, оборудване, производствена среда и т.н., често наричани "одобрение" или "сертифициране" на специален процес. В същото време приемливостта (валидирането) на самия процес не се анализира, по подразбиране се счита за доказано някъде в миналото, не се поддържа от нищо и потвърждението на това валидиране в бъдеще (т.е. повторно валидиране) не е планирани по всякакъв начин.
Важно е да се разбере, че по време на сертифицирането такъв подход трябва да бъде оценен от одиторите като несъответствие с изискванията на първия параграф и последния подпараграф на третия параграф на параграф 7.5.2 от стандарта ISO 9001:2008.
Честно казано, трябва да се отбележи, че в някои организации, когато дефинират понятията „валидиране“, „одобрение“ или „атестация“ на специални процеси, те вземат предвид необходимостта от ДВЕТЕ обстоятелства, обсъдени по-горе, което е, разбира се, правилно. Тук е необходимо да добавим и онези специалисти, които в своите публикации, дефинирайки понятието „валидиране на процеса“, също ВЕДНАГА комбинират основното и частното разрешение за използване в „един пакет“, говорейки за валидиране, например, документирано потвърждение отсъответствие на оборудването, производствените условия, технологичния процес, качеството на полуфабриката и готовия продукт с действащите разпоредби и / или изискванията на нормативната документация. За съжаление обаче селективният анализ показа, че подобни организации и публикации са по-скоро изключение, отколкото правило.
1.6. Как да валидираме специални процеси?
На езика на ISO 9001:2008 валидирането означава, че една организация трябва да направи НЕЩО демонстрират способността на специалните процеси да постигат планирани резултати.Как може да стане това съдържа желания отговор.
За съжаление, в повечето от анализираните "Насоки ..." най-често срещаният вариант беше, когато текстът, без допълнителни коментари или препратки към каквито и да е процедури, просто посочва, че валидиране на процесаПроизводителността на продукта показва способността на процесите да постигат планирани резултати.И това е! Там остана без отговор въпросът КОЛКО ТОЧНО е демонстрирана тази способност. Но това е най-важното.
Изглежда, че горните характеристики на специалните процеси ни позволяват да говорим за два метода за тяхното валидиране.
1.6.1. Валидиране въз основа на оценка на продукта
Спомнете си, че специалните процеси включват, ВКЛЮЧИТЕЛНО, тези, за които проверката съответствието на получените продукти е ТРУДНО.Отбелязваме обаче, че това не означава, че е ПРИНЦИПНО НЕВЪЗМОЖНО. Освен това, поради факта, че такава проверка за редица специални процеси е принципно технически възможна, именно тази техника в повечето случаи се използва за тяхното валидиране.
Ето представителен пример от Ръководството за качество, описващ как се валидира специален процес: чрез определена техническа документацияНа интервали от време характеристиките на продукта се подлагат на инструментален контрол с цел валидиране на процеса и проверка на продукта от този процес.
В същото време внимателният читател ще каже, че този метод за валидиране на производствени процеси вече е описан по-горе и дори е посочен там като често използван. Затова въпросът е дали има разлики в приложението този методвъв връзка със специални процеси?
Отговорът е, че няма методологични разлики между използването на този метод за валидиране за конвенционални и специални производствени процеси. Има обаче ХАРАКТЕРИСТИКИ. Те се крият във факта, че обикновено (както се случва) организирането и проверката на резултатите от специални процеси е много ПО-ТРУДНО от резултатите от други процеси.
Например, по принцип е ВЪЗМОЖНО да се проверят резултатите от процеса на защитно галванично покритие върху продукти, предназначени за работа в екстремни условия. Но за това ще е необходимо „само“ да поставите няколко проби в подходящи условия (директно или да ги създадете изкуствено) и след определен период да приложите разрушителни методи за контрол, които изискват специално оборудване и софтуер, обучен персонал и др. , това е много по-трудно да се организира и направи, отколкото например да се анализира съответствието на геометричните характеристики на продуктите, след като те са били механична обработкаизползвайки стандартни средства за линейно-ъглови измервания.
И все пак основното тук е друго: макар и рядко организациите ПО ПРИНЦИП могат да си позволят това. И те го правят.
Така в един от наръчниците по качеството се посочва, че валидирането на процесите се основава относно резултатите от приемателния контрол и изпитването на експериментална партида произведени продукти:
а) при липса на забележки относно състоянието и работата на оборудването, участващо в сертифицирания производствен процес;
б) при липса на средства за контрол и измерване, участващи в сертифицирания производствен процес, които не са преминали проверка (калибриране) или с просрочена дата на проверка (калибриране);
в) технологичен персонал, който има необходимата квалификация;
г) при условия, когато всички технологични параметри на производството отговарят на изискванията, установени в сертифицираното описание на процеса.
В тази компания процесът се счита за валидиран, ако продуктите са произведени при определените условия напълно отговаря на изискванията, установени в нормативно-техническата документация.
Но що се отнася до повторното валидиране (повторно валидиране) на специални процеси, което е споменато в точка 7.5.2, тогава, като се вземат предвид посочените проблеми, разглежданият метод е малко вероятно да позволи това да се прави често. Във всеки случай е ясно, че проверката на съответствието с геометричните размери може да се направи много по-често, отколкото проверката на характеристиките на защитното покритие. Няма съмнение, че разработчиците на стандарта ISO 9001:2008 са имали предвид това обстоятелство, позволявайки на самата организация да установи или честотата, или конкретните дати за следващите действия за повторно валидиране (повторно валидиране) на специални процеси.
В общия случай критериите за избор на интервал или време за следващото планирано валидиране на специален процес е разумен баланс между важността на поддържането на статуса му на валидиран и способността да се разпределят подходящи трудови, материални, финансови и други ресурси за повторно валидиране. Имайки предвид това, една от компаниите установи, че презаверяването на специални процеси се извършва след една година, както и в рамките на първите два месеца след основен ремонтоборудване, участващо в изпълнението на този процес. В друга компания презаверката се извършва едва след пет години.
Заключение шесто. Валидирането на специални производствени процеси въз основа на проверката на получените продукти методически не се различава от валидирането на други процеси. Въпреки това, способността за разпределяне на ресурси за валидиране и след това повторно валидиране на специални процеси обикновено е значителен проблем, тъй като проверката на резултатите от специални процеси обикновено е по-сложна и отнема много време от резултатите от конвенционалните производствени процеси.
1.6.2. Валидиране въз основа на прогнозни оценки
Е, ако проверката на резултатите от специален процес е възможна по принцип, дори ако това създава допълнителни трудности. Но може да има случаи, когато това е НЕВЪЗМОЖНО - по технически причини, поради времеви ограничения или по икономически причини.
Примери, свързани с технически и времеви обстоятелства, могат да бъдат процесите на създаване на корпус на ядрен реактор, който трябва да издържа на колосално радиационно натоварване в продължение на 30 години, без да губи своите якостни характеристики. За да се проверят напълно тези характеристики, е необходимо да се зареди истински реактор в създадения съд, да се гарантира, че работи в продължение на 30 години и едва след това да се измерят интересните якостни характеристики. Очевидно това е просто невъзможно – нито технически, нито от гледна точка на необходимото време.
Пример за икономически ограничения би бил случаят, когато, за да се валидира процес, е необходимо действително да се унищожи създадения продукт, а той е много скъп и поръчан само в един или няколко екземпляра. Ясно е, че при тези условия производството на друг продукт ИЗКЛЮЧИТЕЛНО за валидиране на производствения му процес, който в този случай ще бъде унищожен, едва ли е икономически оправдано.
В такива случаи е по-разумно да се обсъжда и разглежда само "хипотетичния" резултат от специален процес. В същото време тук отново с различни грешки е възможно да се анализира приемливостта на различни прогнозни варианти за тези резултати, получени на базата на редица добре познати методи: обобщение на експертни гледни точки, аналогии, изчислителни и експериментална екстраполация, моделиране на протичането на самите процеси и условия за последващо приложение или използване на получените продукти и др.
Разбира се, тук несигурността на положителните заключения относно валидирането е много по-висока, отколкото при директната проверка на "живи" резултати от процеса. Следователно, с появата на всяка нова научна и техническа информация и/или нов опит, свързан с методите за извършване на валидиране въз основа на прогнози, е необходимо незабавно да се анализира адекватността на прилаганите досега методи и в зависимост от резултатите от анализа , вземете решение за повторно валидиране, като вземете предвид тези, които са станали налични нови знания.
Седми извод. При липса на възможност за валидиране на специални процеси, базирани на директна проверка на продукти, създадени на тяхна база, тяхното валидиране трябва да се извърши с помощта на предсказуеми методи..
Поради очевидно по-високата несигурност в получените оценки, една организация трябва да обмисли повторно валидиране на специални процеси, когато станат известни нови знания за методите за прогнозиране, използвани за валидиране на тези процеси.
1.7. Всички процеси, наречени „специални“ наистина ли са така?
Отговорът на въпроса какво е "специален процес" е даден по-горе. Не всички обаче споделят тази гледна точка.
Например в публикацията специалните процеси включват процеси, резултатите от които ще бъдат скрити по време на изпълнение на последващи процеси (етапи, етапи).Въпреки това, дори по-нататък, авторите, говорейки за получаване на обективни доказателства, необходими за валидирането на ТАКИВА процеси, се позовават на доказателства резултати от ПРИЕМАНЕ и/или ОГЛЕД на скрити работи, отделно представени операции, оперативен контрол.Това означава, че проверката на резултатите от тези процеси е не само възможна, но и СЕ ИЗВЪРШВА, при това всъщност ВИНАГИ. И това не попада в признаците на специални процеси, описани в стандарта ISO 9000:2005.
Голяма част от споровете са свързани с наличието или липсата на специални процеси при предоставянето на услугите. Така например авторите се позовават на спец процеси, които включват предоставянеуслуги в реално време и се извършват директно в точката на контакт с потребителя (например настаняване и напускане на клиента в хотела или осигуряване на ремонт на продукти на място на клиента).
По същия начин, говорейки за процеса на предоставяне образователни услуги, авторите не поставят под въпрос факта, че образователендейност е процес, чиито резултати не могат да бъдат проверени чрез последващ мониторинг или измерване.
Авторът вярва, че специалните процеси ПЪРВОНАЧАЛНО са част само от тези услуги, които се предоставят ЛИЧНО. Що се отнася до услугите, предоставяни в PRIMARY, в повечето случаи няма специални процеси, за които авторът вече говори по-рано в публикацията. Следователно авторът споделя мнението, изразено в публикации, които разглеждат процесите като такива, свързани с контрол и изследване (рентгенграфики, откриване на цветни дефекти, ултразвуков контрол, изпитване под налягане и др.).И авторите повтарят дума по дума и също подкрепят авторите, заявявайки това методи за изпитване на продуктаПрепоръчай на централни обекти на валидиране.
И тук авторът е готов да спори, вярвайки, че само онези процеси на контрол, които се основават на унищожаването / повредата на изследвания продукт или които не могат да бъдат използвани повторно за същия продукт поради изключително висока скоростнейното стареене.
Във всички останали случаи РЕЗУЛТАТИТЕ от контрола МОГАТ да бъдат проверени чрез повторение на същото контролни операции, или чрез използване на ДРУГИ методи за контрол. И следователно те не попадат в определението за "специален процес".
Има много други примери за идентифициране на някои процеси като специални от някои автори и несъгласие с тях от други, включително примерите, дадени в самото начало на статията.
Заключение осмо. Въпросът дали даден процес е специален или не е много често спорен и има директно противоположни гледни точки.
В същото време изглежда, че подобни спорове са незначителни, тъй като всъщност НЯМА ЗНАЧЕНИЕ дали този или онзи производствен процес се класифицира като специален или не, най-общо казано.
2. Колко важно е да се разграничат „специалните процеси“ от производствените процеси?
2.1. Валидиране на производствените процеси: дали е само „специално“?
Ако внимателно анализираме изискванията на други раздели на стандарта ISO 9001:2008, по-специално клауза 7.1, ще видим, че стандартът НАИСТИНА предполага, че валидираните, т.е. основно разрешение за използване,имаше не само специални процеси, но всъщност ВСИЧКИ процеси за производство на продукти. Нека анализираме следните три стандартни ситуации.
a) Ако организацията използва ТИПИЧНИ производствени операции/процеси, тогава те са валидирани по дефиниция, тъй като не могат да бъдат признати за типични без съответното им валидиране.
b) Ако една организация използва процеси, ЗАЕТИ от други организации, за да произвежда продукти, тогава е разумно да се предположи, че организацията не може да разглежда заемане за себе си, докато не получи доказателство за валидирането на тези процеси.
в) Най-трудната ситуация е, когато производствените процеси се СЪЗДАВАТ в самата организация - в съответствие с буква б) от параграф 7.1. Имайте предвид обаче, че в този случай стандартът изисква организацията да:
1) установени изисквания, свързани с продукта, включително критерии за приемане.И би било напълно нелогично да мислим, че тези изисквания НЯМА да включват тези, които се отнасят до конкретното му предназначение или приложение - както по отношение на крайния продукт, така и по отношение на неговите междинни състояния или полуготови продукти;
разработи процесите, необходими за създаване на продукти(включително, разбира се, процесите на ПРОИЗВОДСТВО на продуктите, а не само процесите на проектиране, доставки, контрол и т.н.), както и създаде необходимите записи за предоставяне на доказателства, че процесите за създаване на продукти отговарят на изискванията. И тук би било нелогично да мислим, че тези последни изисквания НЯМА да включват изискването да се гарантира, че получените продукти отговарят на горните критерии за приемане.
Следователно една организация ще счита за приемлив само разработен производствен процес, който ще гарантира, че полученият продукт отговаря на изискванията за неговата специфична предназначена употреба или приложение. Това означава, че ТРЯБВА да бъде правилно валидиран.
С оглед на гореизложеното, във всяка организация, работеща по модела ISO 9001:2008, всички производствени процеси на продукти ТРЯБВА първоначално да бъдат класифицирани като валидирани 8 . По тази причина твърдението на авторите |7, p. 33] това критерииниа на процесите на всяка организация към VAPIABLE е САМО, че те не могат да бъдат проверени чрез последващо наблюдение и измерване.
Заключение девето. Въпреки че не е посочено директно, в стандартния моделISO 9001:2008 по своята СЪЩНОСТ предполага, че ВСИЧКИ прилагани производствени процеси трябва да бъдат подложени на процедура за валидиране. И по отношение на онези производствени процеси, които самата организация развива, това всъщност е пряко изискване.
2.2. Секцията изисква ли 7.5.2 валидиране на други процеси на СУК?
Въз основа на логиката на управлението на качеството валидирането е необходимо не само за всички производствени процеси, но и за ВСЕКИ процес като цяло, който е посочен в клауза 4.1 на ISO 9001:2008 необходими за СУК.В противен случай няма да има гаранция, че по време на изпълнението на невалидиран процес неговият „изход“ ще съответства на желания резултат.
Други автори също изтъкват това обстоятелство, отбелязвайки: Философията за качество гласи, че най-рентабилният начин за правене на бизнес е прилагането на философията на специалните процеси към всички процеси на организацията. Авторът напълно споделя тази гледна точка.
В същото време още веднъж подчертаваме, че в стандарта ISO 9001:2008 изискването за необходимост от валидиране на процесите присъства директно само в точка 7.5.2 и е свързано САМО с процесите на производство на продукта. Това означава, че, строго погледнато, изискването за валидиране не се прилага за никакви други процеси, освен за конкретни производствени процеси на продукти. По-специално, това изискване не се отнася за процесите на проектиране и разработка, въпреки че последните често се споменават, когато се обсъждат проблемите на тълкуването на термина „валидиране“.
Заключение десето. Изисквания на точка 7.5.2 от стандартаISO 9001:2008 се отнася изключително за специални процеси за производство на продукти и тяхното обслужване и не се прилага за други процеси, необходими за QMS.
2.3. Колко е важно да не допуснете грешка при приписването производствен процесна "специален"?
Ясно е, че ако някой производствен процес НЕОБОСНОВАНО бъде класифициран като специален, това ще бъде методологична грешка. Но от гледна точка на целите на управлението на качеството, това е „грешка в по-добра страна". Тъй като след това изискванията на клауза 7.5.2 от стандарта ISO 9001:2008 ще трябва да бъдат разширени до такъв процес, а именно: той ще трябва да бъде ВАЛИДИРАН и да започне прилагането само след получаване на лично разрешение за използване. И това без съмнение е добре за организацията.
Но това е съвсем различен въпрос, когато процесът е по своята същност специален, но не е идентифициран като такъв и следователно изискванията на клауза 7.5.2 с всички произтичащи от това последици не са разширени към него. Въпреки това изглежда, че страховете за катастрофалните последици от тези последствия са „силно преувеличени“.
От казаното по-горе читателят трябва да разбере, че ВСЕКИ производствен процес трябва действително да бъде валидиран преди използването му (което в „нормалните“ компании на практика се случва) и след това да се извърши при контролирани условия, чието съдържание е посочено в клауза 7.5 .първо. А това означава, че за тези процеси, ако отговарят на изискванията на ал. 7.1 и 7.5.1, всички изисквания на точка 7.5.2 ще бъдат изпълнени АВТОМАТИЧНО, с изключение само на една точка - относно презаверката.
Заключение единадесето.Ако организацията НАПЪЛНО изпълнява изискванията на ал. 7.1 и 7.5.1 стандартISO 9001:2008, тогава некласифицирането на някои процеси като „специални“ не води автоматично до несъответствие с изискванията на точка 7.5.2. Стандартен моделISO 9001:2008 ДЕЙСТВИТЕЛНО принуждава организацията както да валидира такива процеси, така и да приложи към тях всички други изисквания на точка 7.5.2 (с възможното изключение на изискванията за повторно валидиране), без дори да прави пряка препратка към него.
Това води до много важна последица за организациите. Ако по време на сертифицирането одиторите стигнат до заключението, че даден процес по своята същност е ad hoc, но организацията не му е дала този статус, това НЕ ТРЯБВА автоматично да води до несъответствие с изискванията на 7.5.2. Напълно възможно е ДЕЙСТВИТЕЛНО всички изисквания на този раздел в тази организация да бъдат изпълнени в хода на изпълнение на изискванията на параграфи. 7.1 и 7.5.1. Одиторите са длъжни да разберат ДОПЪЛНИТЕЛНО, така че решението им за съответствие или несъответствие с изискванията на точка 7.5.2 да бъде напълно обосновано.
И още един въпрос.
Ами ако в организацията, при анализ на производствените процеси, се разкрие, че тя вече използва някои процеси от дълго време, които (въз основа на стандарта ISO 9000:2005) трябва да бъдат идентифицирани като „специални“, но които преди това НЕ СА УПРАВЛЯВАНИ напълно, както се изисква в точка 7.5.2 от ISO 9001:2008?
Отговорът тук е недвусмислен: организацията трябва да ЗАПОЧНЕ управлението на тези процеси в съответствие с изискванията на точка 7.5.2, като започне с ОФИЦИАЛНОТО им валидиране/повторно валидиране.
Заключение дванадесето.Във всички случаи е препоръчително всяка сертифицирана организация периодично (например веднъж годишно) да анализира своите производствени процеси, за да изясни тези, които отговарят на определението за „специални“ и да разшири изискванията на точка 7.5.2 от ISO стандарт за тях. 9001:2008.
2.4. Така че необходимо ли е да се отделят „специални“ производствени процеси?
Отчитайки реалната практика на прилагане в SM K на изискванията на ал. 7.1 и 7.5.2 и разчитайки на аргумента за полезност, авторът не се колебае да отговори утвърдително на този въпрос. Освен това той би сметнал за рационално ВСИЧКИ производствени процеси да бъдат признати за „специални“. Но с едно предупреждение. Когато разпознава даден процес като „специален“ и/или „много важен“, организацията трябва да:
1. ИНСТАЛИРАНЕ методология за неговото валидиране, ПОСТИГНЕТЕ неговото валидиране и ИНСТАЛИРАЙТЕрежим на претоварване.По този начин може да посочи наличието на основно разрешение за използване на този процес.
2. Преди всяка конкретна употреба предприемете стъпки за получаване на лично разрешение за тази употреба въз основа на УСТАНОВЕНИ КРИТЕРИИ анализ и разпознаванеприемливост на процеса за използване,което трябва да включва поне признаниепригодността на планираното за използване оборудване и ангажирания персонал.
Осигурете надзор през целия процес, за да гарантирате това само по предназначениеТОЧНО ЗА ТОЗИ ПРОЦЕСметоди и процедурии БЯХА ПАЗЕНИ ЗАПИСИ, потвърждаващи осигуряване както на изпълнението на критериите за приемане на процеса, така и на съответствие с установените методи и процедури.Заключение тринадесето. Кръг от производствени процеси,които организацията счита за критични или особено важни, може да са извън обхвата на процесите, които са ad hoc. Класифицирането на даден процес като критичен предполага Специално вниманиеза подготовката и изпълнението му. Най-добрият механизъм за прилагане на това е да се разширят изискванията на точка 7.5.2 от стандарта за такива процеси. ISO 9001:2008.
Заключение
Идеологическа. Появата в текста на клауза 7.5.2 на ISO 9001:2008 подчертава значението на вниманието, което Международната организация по стандартизация счита за необходимо да се обърне в организациите на специални процеси поради повишения риск, свързан с тях за управлението на качеството поради тяхната специфика.
Въпреки факта, че правилата за управление на производствените процеси, формулирани в ал. 7.1 и 7.5.1 са по същество същите като в 7.5.2, изпълнението на изискванията на последния раздел позволява на организацията да бъде много по-уверена в минимизирането на рисковете, свързани с възможно неразбиране на характеристиките на управление на точно такива процеси. Като се има предвид „критичността“, присъща на специалните процеси, подобен подход изглежда напълно оправдан.
Повишеното внимание, изисквано от стандарта за специални процеси, логично трябва да се разшири и за всички други критични процеси.
Методически. При преминаване на сертификация за всеки прилаган специален процес е необходимо да се докаже наличието на комбинация от две одобрения за тяхното използване. Първият (основен) е под формата на доказателство за валидността на процеса, т.е. доказателство за способността му по принцип да постигне планираните резултати.
Вторият (частен) е под формата на потвърждение за готовността на процеса за конкретното му приложение. Обикновено това се случва в резултат на разработването и изпълнението на планове. техническо обучениесъответно производство. Критерият за наличието на това разрешение е изпълнението на изискванията, установени в описанието на процеса за всички компоненти, включени в процеса, а именно: за изпълнители, оборудване, изходни материали, производствена среда и др.
Нито едно от тези две разрешения не замества другото. И двете трябва да са налични.
Практичен. Ако специален процес има и двете от горните разрешения за използване, степента на увереност в получаването на желания резултат ще зависи в бъдеще само от едно нещо - колко точно се спазват технологичните режими, установени от разработчиците. За да бъде сигурна в това, организацията трябва да създаде и поддържа подходящи записи.
Изглежда, че именно в тези три обстоятелства се съдържа ключовият смисъл на изискванията на клауза 7.5.2 на ISO 9001:2008, които авторът препоръчва на всяка организация да разшири и други важни за СУК процеси.
1 Тук и по-долу цитатите от документи са с удебелен курсив. Подборът на думи и изрази с главни (главни) букви се извършва от автора. Цитирането на отделни наръчници по качество с позоваване на компаниите, които са ги разработили, се извършва само в отделни случаи.
2 Цитираната разпоредба е взета от Наръчника по качество на университета, който преди това беше публикуван на сайта му, но към момента на подготовка на статията за публикуване по някаква причина беше премахнат от там.
3 Въпреки че има някои доста странни изключения. Например, който започна да се публикува в специализирано списание по проблемите на управлението на качеството “ Терминологичен речниксистема за техническо регулиране“ не съдържа термина „валидиране“.
4 Трябва да се отбележи, че в постсъветското пространство терминът „сертифициране на процеса“ остава в употреба. Често се използва вместо термина "валидиране". Проблемът е, че в някои случаи това наистина е еквивалент на валидиране, например когато сертифицирането на производствените процеси е определено в Ръководството за качество като документално потвърждение, че процесът, протичащ в установените параметри, осигурява ефективно, ефикасно и възпроизводимо производство на ПРОДУКТИ, КОИТО ОТГОВАРЯТ НА УСТАНОВЕНИТЕ ИЗИСКВАНИЯ и стандарти за качество.Но в други наръчници за качество съдържанието на действията, наречени „сертифициране на процеса“, не може да се припише на неговото валидиране. Това се обсъжда по-подробно в следващите раздели на статията.
5 Естествено, тук не разглеждаме ситуацията, когато по една или друга причина, ИЗВЪН логиката на управлението на качеството, някое лице, по силата на дадените му правомощия, допуска използването на невалидиран процес. В такива случаи трябва да се говори не за "разрешение", а за "заповед".
6 Строго погледнато, клауза 7.5.2 не говори за материали, суровини и компоненти, както и за работната среда. Това обаче изглежда е чисто "текстовен" недостатък в този раздел, тъй като тези изисквания се съдържат в други раздели на стандарта, СЪЩО приложими за специални процеси - параграфи. 7.4 и 6.4.
7 Строго погледнато, 7.5.2 се отнася САМО до ПРОИЗВОДСТВЕНИТЕ процеси на продукта, а не до процесите на КОНТРОЛ на продукта (повече за това по-долу). Авторът включва обсъждане на тези процеси в статията само от гледна точка на допълнителна илюстрация на грешките при класифицирането на някои от процесите като специални като такива.
8 В някои стандарти за системи за управление на качеството, обсъжданата разпоредба от категорията на препоръките беше прехвърлена в категорията на ПРЕКИТЕ изисквания. Например, точка 7.5.2.1 от ISO/TS 16949:2009 гласи: изискванията на раздел 7.5.2 се прилагат за всички производствени и сервизни процеси






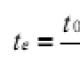



Само влюбените ще оцелеят
Характеристики на рекламата, насочена към деца
ретуширане на стари снимки във photoshop ретуширане на стари снимки
Какво е НПО: декодиране, дефиниране на цели, видове дейности Има ли право организация с нестопанска цел
Глеб Никитин първи зам