 Normizacija je aktivnost utvrđivanja pravila i svojstava u svrhu njihove dobrovoljne ponovne uporabe, s ciljem postizanja uređenosti u područjima proizvodnje i prometa proizvoda te povećanja konkurentnosti.
Normizacija je aktivnost utvrđivanja pravila i svojstava u svrhu njihove dobrovoljne ponovne uporabe, s ciljem postizanja uređenosti u područjima proizvodnje i prometa proizvoda te povećanja konkurentnosti.
 Normizacija u području prometa lijekova usmjerena je na osiguranje kvalitete standardiziranog objekta, koji uključuje proizvode (sirovine i materijale, gotove lijekove itd.), usluge, procese.
Normizacija u području prometa lijekova usmjerena je na osiguranje kvalitete standardiziranog objekta, koji uključuje proizvode (sirovine i materijale, gotove lijekove itd.), usluge, procese.
 Normizacija u odnosu na područje prometa lijekova je proces uspostavljanja i primjene standarda koji sadrže skup normi, pravila, zahtjeva za predmet standardizacije, uključujući sve lijekove, uključujući homeopatske, parafarmaceutske proizvode, usluge i procese u području promet lijekova, jamčeći njihovu kvalitetu.
Normizacija u odnosu na područje prometa lijekova je proces uspostavljanja i primjene standarda koji sadrže skup normi, pravila, zahtjeva za predmet standardizacije, uključujući sve lijekove, uključujući homeopatske, parafarmaceutske proizvode, usluge i procese u području promet lijekova, jamčeći njihovu kvalitetu.
 Svrha normizacije u području prometa lijekova je zaštita potrošača i države od kvalitete farmaceutskih proizvoda, procesa njihove proizvodnje, promocije, skladištenja, uništavanja itd. Dakle, standardizacija je usmjerena na osiguranje farmakoloških, ekoloških, tehnoloških sigurnost, racionalno korištenje resursa.
Svrha normizacije u području prometa lijekova je zaštita potrošača i države od kvalitete farmaceutskih proizvoda, procesa njihove proizvodnje, promocije, skladištenja, uništavanja itd. Dakle, standardizacija je usmjerena na osiguranje farmakoloških, ekoloških, tehnoloških sigurnost, racionalno korištenje resursa.
 Načela koja se provode tijekom normizacije: 1. Dobrovoljna uporaba normi i osiguranje uvjeta za njihovu jedinstvenu primjenu. 2. Korištenje međunarodne norme kao temelja za razvoj nacionalne norme, osim u slučajevima kada usklađenost sa zahtjevima međunarodnim standardima nemoguće zbog nedosljednosti njihovih zahtjeva s klimatskim i geografskim značajkama Ruske Federacije ili tehničkim (tehnološkim) značajkama. Konkretno, nacrti općih farmakopejskih članaka za XII Državnu farmakopeju uzimaju u obzir suvremene zahtjeve stranih farmakopeja.
Načela koja se provode tijekom normizacije: 1. Dobrovoljna uporaba normi i osiguranje uvjeta za njihovu jedinstvenu primjenu. 2. Korištenje međunarodne norme kao temelja za razvoj nacionalne norme, osim u slučajevima kada usklađenost sa zahtjevima međunarodnim standardima nemoguće zbog nedosljednosti njihovih zahtjeva s klimatskim i geografskim značajkama Ruske Federacije ili tehničkim (tehnološkim) značajkama. Konkretno, nacrti općih farmakopejskih članaka za XII Državnu farmakopeju uzimaju u obzir suvremene zahtjeve stranih farmakopeja.
 Načela koja se provode u postupku normizacije: 3. Nedopustivost stvaranja prepreka proizvodnji i prometu proizvoda, obavljanju poslova i pružanju usluga u većem obimu nego što je to minimalno potrebno za postizanje ciljeva normizacije. 4. Ravnoteža interesa strana koje razvijaju, pružaju i konzumiraju proizvode (usluge). Ovo načelo znači da sudionici u normizacijskom radu, na temelju sposobnosti proizvođača proizvoda i pružatelja usluga, s jedne strane, i zahtjeva potrošača, s druge strane, moraju pronaći konsenzus, koji se shvaća kao opći sporazum. Drugim riječima: nedostatak primjedbi na značajna pitanja od strane većine dionika, želja da se uzmu u obzir mišljenja svih strana i spoje različita stajališta. 5. Dosljednost normizacije, što podrazumijeva razmatranje predmeta normizacije kao dijela složenijeg sustava.
Načela koja se provode u postupku normizacije: 3. Nedopustivost stvaranja prepreka proizvodnji i prometu proizvoda, obavljanju poslova i pružanju usluga u većem obimu nego što je to minimalno potrebno za postizanje ciljeva normizacije. 4. Ravnoteža interesa strana koje razvijaju, pružaju i konzumiraju proizvode (usluge). Ovo načelo znači da sudionici u normizacijskom radu, na temelju sposobnosti proizvođača proizvoda i pružatelja usluga, s jedne strane, i zahtjeva potrošača, s druge strane, moraju pronaći konsenzus, koji se shvaća kao opći sporazum. Drugim riječima: nedostatak primjedbi na značajna pitanja od strane većine dionika, želja da se uzmu u obzir mišljenja svih strana i spoje različita stajališta. 5. Dosljednost normizacije, što podrazumijeva razmatranje predmeta normizacije kao dijela složenijeg sustava.
 Načela koja se provode tijekom normizacije: 6. Dinamičnost i napredni razvoj norme - dokument koji utvrđuje karakteristike proizvoda i procesa za njihovu proizvodnju, rad, skladištenje, transport, prodaju i zbrinjavanje, kao i pravila za njihovu primjenu. Dinamičnost se osigurava periodičnom revizijom regulatornih dokumenata, njihovim izmjenama ili poništavanjem. Napredni razvoj je olakšan uvođenjem u normu obećavajućih zahtjeva za proizvode, procese, metode njihove kontrole, pokazatelje kvalitete itd. 7. Učinkovitost normizacije, izražena u ekonomskom ili društvenom učinku. 8. Usklađivanje normi sa zahtjevima tehničkih propisa. 9. Jasnoća i nedvosmislenost teksta odredbi norme. 10. Složenost standardizacije međusobno povezanih objekata. 11. Objektivnost provjere zahtjeva.
Načela koja se provode tijekom normizacije: 6. Dinamičnost i napredni razvoj norme - dokument koji utvrđuje karakteristike proizvoda i procesa za njihovu proizvodnju, rad, skladištenje, transport, prodaju i zbrinjavanje, kao i pravila za njihovu primjenu. Dinamičnost se osigurava periodičnom revizijom regulatornih dokumenata, njihovim izmjenama ili poništavanjem. Napredni razvoj je olakšan uvođenjem u normu obećavajućih zahtjeva za proizvode, procese, metode njihove kontrole, pokazatelje kvalitete itd. 7. Učinkovitost normizacije, izražena u ekonomskom ili društvenom učinku. 8. Usklađivanje normi sa zahtjevima tehničkih propisa. 9. Jasnoća i nedvosmislenost teksta odredbi norme. 10. Složenost standardizacije međusobno povezanih objekata. 11. Objektivnost provjere zahtjeva.
 Faze postupka normizacije 1. Izbor objekata normizacije. 2. Opis objekta, uzimajući u obzir osnovne zahtjeve, tj. njegovo modeliranje. 3. Optimizacija modela u smislu objedinjavanja objekta korištenjem metoda sistematizacije, tipizacije, pojednostavljenja (identifikacija neprikladnih objekata) itd. 4. Standardizacija modela - izrada regulatornog dokumenta (RD) na temelju jedinstvenog model.
Faze postupka normizacije 1. Izbor objekata normizacije. 2. Opis objekta, uzimajući u obzir osnovne zahtjeve, tj. njegovo modeliranje. 3. Optimizacija modela u smislu objedinjavanja objekta korištenjem metoda sistematizacije, tipizacije, pojednostavljenja (identifikacija neprikladnih objekata) itd. 4. Standardizacija modela - izrada regulatornog dokumenta (RD) na temelju jedinstvenog model.
 Dakle, konačni dokument normizacije je normativni dokument koji utvrđuje pravila generalni principi ili karakteristike raznih aktivnosti ili njihovih rezultata. Pojam "regulatorni dokument" je generički i pokriva koncepte kao što su standardi i drugi normativni dokumenti o normizaciji: pravila, preporuke, kodeksi prakse, sveruski klasifikatori.
Dakle, konačni dokument normizacije je normativni dokument koji utvrđuje pravila generalni principi ili karakteristike raznih aktivnosti ili njihovih rezultata. Pojam "regulatorni dokument" je generički i pokriva koncepte kao što su standardi i drugi normativni dokumenti o normizaciji: pravila, preporuke, kodeksi prakse, sveruski klasifikatori.
 Standard je standard ili uzorak uzet kao referenca za usporedbu drugih sličnih objekata s njim. Norma kao ND utvrđuje skup normi i zahtjeva za predmet normizacije. Primjena standarda pridonosi poboljšanju kvalitete proizvoda. Norma - dokument u kojem se, u svrhu dobrovoljne ponovne uporabe, utvrđuju karakteristike proizvoda, pravila provedbe i karakteristike procesa, proizvodnje, rada, skladištenja, transporta, prodaje i zbrinjavanja, izvođenja radova ili pružanja usluga. Norma može sadržavati zahtjeve za terminologiju, simbole, pakiranje, označavanje ili etikete i pravila za njihovu primjenu.
Standard je standard ili uzorak uzet kao referenca za usporedbu drugih sličnih objekata s njim. Norma kao ND utvrđuje skup normi i zahtjeva za predmet normizacije. Primjena standarda pridonosi poboljšanju kvalitete proizvoda. Norma - dokument u kojem se, u svrhu dobrovoljne ponovne uporabe, utvrđuju karakteristike proizvoda, pravila provedbe i karakteristike procesa, proizvodnje, rada, skladištenja, transporta, prodaje i zbrinjavanja, izvođenja radova ili pružanja usluga. Norma može sadržavati zahtjeve za terminologiju, simbole, pakiranje, označavanje ili etikete i pravila za njihovu primjenu.
 Podjela normi ovisno o opsegu 1. međunarodne, koje donosi međunarodna organizacija. 2. nacionalni, odobren od nacionalnog tijela Ruske Federacije za normizaciju. 3. država (industrija), koju provodi državna izvršna vlast. Na primjer, državni obrazovni standardi područje su nadležnosti Ministarstva obrazovanja Ruske Federacije. 4. standard poduzeća.
Podjela normi ovisno o opsegu 1. međunarodne, koje donosi međunarodna organizacija. 2. nacionalni, odobren od nacionalnog tijela Ruske Federacije za normizaciju. 3. država (industrija), koju provodi državna izvršna vlast. Na primjer, državni obrazovni standardi područje su nadležnosti Ministarstva obrazovanja Ruske Federacije. 4. standard poduzeća.
 Standard kvalitete lijeka je regulatorni dokument koji sadrži popis standardiziranih pokazatelja i metoda za kontrolu kvalitete lijeka, odobren od resornog ministarstva.
Standard kvalitete lijeka je regulatorni dokument koji sadrži popis standardiziranih pokazatelja i metoda za kontrolu kvalitete lijeka, odobren od resornog ministarstva.
 Standardi kvalitete za lijekove Odredbe standarda su obvezne za organizacije za razvoj lijekova i proizvođače odjelna pripadnost, pravni status i oblika vlasništva te za organizacije i ustanove koje provode ispitivanje standarda kvalitete lijekova.
Standardi kvalitete za lijekove Odredbe standarda su obvezne za organizacije za razvoj lijekova i proizvođače odjelna pripadnost, pravni status i oblika vlasništva te za organizacije i ustanove koje provode ispitivanje standarda kvalitete lijekova.
 Norma se ne odnosi na razvoj i proizvodnju farmaceutskih proizvoda: - iz krvi i njezinih nadomjestaka koji se koriste u transfuziologiji; - od sirovina životinjskog podrijetla, koristi se samo za pripremu proizvoda koji podliježu daljnjem industrijska prerada za pripremu lijekova; - strana proizvodnja; - proizvedeno u ljekarnama.
Norma se ne odnosi na razvoj i proizvodnju farmaceutskih proizvoda: - iz krvi i njezinih nadomjestaka koji se koriste u transfuziologiji; - od sirovina životinjskog podrijetla, koristi se samo za pripremu proizvoda koji podliježu daljnjem industrijska prerada za pripremu lijekova; - strana proizvodnja; - proizvedeno u ljekarnama.
 Standardi kvalitete koji utvrđuju zahtjeve za lijekove podijeljeni su u sljedeće kategorije: - Državni standardi kvalitete lijekova (GSKLS); - Farmakopejski članak poduzeća (FSP) o lijekovima određenog poduzeća.
Standardi kvalitete koji utvrđuju zahtjeve za lijekove podijeljeni su u sljedeće kategorije: - Državni standardi kvalitete lijekova (GSKLS); - Farmakopejski članak poduzeća (FSP) o lijekovima određenog poduzeća.
 Državni standardi kvalitete Ø opći farmakopejski članak (GPM) - uključuje popis normaliziranih pokazatelja ili metoda ispitivanja za određeni oblik doziranja, opis fizičkih, fizikalno-kemijskih, biokemijskih, bioloških, mikrobioloških metoda analize lijekova, zahtjeve za korištene reagense , titrirane otopine, indikatori. Ø farmakopejska monografija (FS). Razvijen za monokomponentne lijekove međunarodnog nezaštićenog naziva (INN) i sadrži obvezni popis pokazatelji i metode kontrole kvalitete lijeka (uzimajući u obzir njegov oblik doziranja) koji udovoljavaju zahtjevima vodećih stranih farmakopeja. Ø OFS i FS čine Državnu farmakopeju (SP).
Državni standardi kvalitete Ø opći farmakopejski članak (GPM) - uključuje popis normaliziranih pokazatelja ili metoda ispitivanja za određeni oblik doziranja, opis fizičkih, fizikalno-kemijskih, biokemijskih, bioloških, mikrobioloških metoda analize lijekova, zahtjeve za korištene reagense , titrirane otopine, indikatori. Ø farmakopejska monografija (FS). Razvijen za monokomponentne lijekove međunarodnog nezaštićenog naziva (INN) i sadrži obvezni popis pokazatelji i metode kontrole kvalitete lijeka (uzimajući u obzir njegov oblik doziranja) koji udovoljavaju zahtjevima vodećih stranih farmakopeja. Ø OFS i FS čine Državnu farmakopeju (SP).
 GF - zbirka državni standardi kvalitete lijekova, što je zakonodavne prirode. Globalni fond temelji se na načelima nacionalne zdravstvene zaštite i odražava suvremena dostignuća u području farmacije, medicine, kemije i drugih srodnih znanosti. Globalni fond sastavni je dio sveobuhvatnog sustava za osiguranje kvalitete farmaceutskih proizvoda, njegovi su zahtjevi obvezni za sva poduzeća i institucije uključene u promet lijekova, bez obzira na vlasništvo i podređenost odjela.
GF - zbirka državni standardi kvalitete lijekova, što je zakonodavne prirode. Globalni fond temelji se na načelima nacionalne zdravstvene zaštite i odražava suvremena dostignuća u području farmacije, medicine, kemije i drugih srodnih znanosti. Globalni fond sastavni je dio sveobuhvatnog sustava za osiguranje kvalitete farmaceutskih proizvoda, njegovi su zahtjevi obvezni za sva poduzeća i institucije uključene u promet lijekova, bez obzira na vlasništvo i podređenost odjela.
 Jedan od temeljnih standarda ove razine je Međunarodna farmakopeja (IP), koja utvrđuje prihvatljive standarde za snagu, čistoću i kvalitetu farmaceutskih proizvoda koji dolaze na tržište. međunarodno tržište. MF je alternativa nekim široko primjenjivim nacionalnim i regionalnim farmakopejama. Njegov glavni cilj je prilagoditi se potrebama zemalja u razvoju nudeći pouzdane standarde kvalitete temeljene na klasičnim metodama, čime osigurava državna jamstva za lijekove. Glavne smjernice za izradu domaćih državnih standarda kvalitete lijekova su Europska, Britanska farmakopeja i Farmakopeja SAD-a.
Jedan od temeljnih standarda ove razine je Međunarodna farmakopeja (IP), koja utvrđuje prihvatljive standarde za snagu, čistoću i kvalitetu farmaceutskih proizvoda koji dolaze na tržište. međunarodno tržište. MF je alternativa nekim široko primjenjivim nacionalnim i regionalnim farmakopejama. Njegov glavni cilj je prilagoditi se potrebama zemalja u razvoju nudeći pouzdane standarde kvalitete temeljene na klasičnim metodama, čime osigurava državna jamstva za lijekove. Glavne smjernice za izradu domaćih državnih standarda kvalitete lijekova su Europska, Britanska farmakopeja i Farmakopeja SAD-a.
 Farmakopejski članak poduzeća (FSP) je standard kvalitete za lijek pod trgovačkim nazivom, koji sadrži popis pokazatelja i metoda za kontrolu kvalitete lijeka proizvedenog od strane određenog poduzeća, uzimajući u obzir specifičnu tehnologiju ovog poduzeća i propisno registriranog.
Farmakopejski članak poduzeća (FSP) je standard kvalitete za lijek pod trgovačkim nazivom, koji sadrži popis pokazatelja i metoda za kontrolu kvalitete lijeka proizvedenog od strane određenog poduzeća, uzimajući u obzir specifičnu tehnologiju ovog poduzeća i propisno registriranog.
 FSP, koji je stvorila razvojna organizacija ili proizvodno poduzeće u vezi sa svojom proizvodnjom, predmet je njihovog autorskog prava. FSP sadrži popis pokazatelja kvalitete tvari ili lijeka koje proizvodi određeno poduzeće, s detaljnim opisom metoda za njihovu ocjenu. Dakle, ovaj dokument odražava specifičnu tehnologiju određenog poduzeća u proizvodnji specifične proizvode, položio ispit i državnu registraciju. Norme navedene u FSP-u mogu biti znatno strože, ali ne niže od onih zahtjeva predviđenih OFS-om. Standardi poduzeća mogu se razlikovati od FS-a korištenjem drugih alternativnih, ekonomičnijih, bržih, automatiziranih ili točnijih metoda analize i testiranja; uvođenje dodatnih karakteristika; uključenje, Ubrajanje Detaljan opis uzorkovanje, čime se osigurava viša razina standardizacije serijskih proizvoda; upotrebom strožih tolerancija i ograničenja kako bi se stvorila margina sigurnosti, smanjio rizik da rezultat bude izvan raspona zbog heterogenosti serije ili pogreške metode. Rok valjanosti FSP-a utvrđuje se nakon njegovog odobrenja, uzimajući u obzir razinu tehnološkog procesa proizvodnje određenog lijeka, ali ne više od 5 godina.
FSP, koji je stvorila razvojna organizacija ili proizvodno poduzeće u vezi sa svojom proizvodnjom, predmet je njihovog autorskog prava. FSP sadrži popis pokazatelja kvalitete tvari ili lijeka koje proizvodi određeno poduzeće, s detaljnim opisom metoda za njihovu ocjenu. Dakle, ovaj dokument odražava specifičnu tehnologiju određenog poduzeća u proizvodnji specifične proizvode, položio ispit i državnu registraciju. Norme navedene u FSP-u mogu biti znatno strože, ali ne niže od onih zahtjeva predviđenih OFS-om. Standardi poduzeća mogu se razlikovati od FS-a korištenjem drugih alternativnih, ekonomičnijih, bržih, automatiziranih ili točnijih metoda analize i testiranja; uvođenje dodatnih karakteristika; uključenje, Ubrajanje Detaljan opis uzorkovanje, čime se osigurava viša razina standardizacije serijskih proizvoda; upotrebom strožih tolerancija i ograničenja kako bi se stvorila margina sigurnosti, smanjio rizik da rezultat bude izvan raspona zbog heterogenosti serije ili pogreške metode. Rok valjanosti FSP-a utvrđuje se nakon njegovog odobrenja, uzimajući u obzir razinu tehnološkog procesa proizvodnje određenog lijeka, ali ne više od 5 godina.
 Ispitivanje svih izrađenih i revidiranih ND provodi Povjerenstvo za farmakopeju. Po potrebi, u dogovoru s proizvođačem, specijalizirane organizacije mogu se uključiti u provođenje eksperimentalne provjere standarda kakvoće lijeka. Tijekom ispitivanja provjeravaju: - znanstveno-tehničku razinu nacrta norme i njezinu usklađenost modernim zahtjevima GF XI i GF XII izdanja; - Valjanost popisa pokazatelja kvalitete; - optimalnost vrijednosti standarda kvalitete i roka trajanja lijekova; - točnost i jednoznačnost korištenih pojmova, definicija, kemijske nomenklature i jedinica fizikalnih veličina.
Ispitivanje svih izrađenih i revidiranih ND provodi Povjerenstvo za farmakopeju. Po potrebi, u dogovoru s proizvođačem, specijalizirane organizacije mogu se uključiti u provođenje eksperimentalne provjere standarda kakvoće lijeka. Tijekom ispitivanja provjeravaju: - znanstveno-tehničku razinu nacrta norme i njezinu usklađenost modernim zahtjevima GF XI i GF XII izdanja; - Valjanost popisa pokazatelja kvalitete; - optimalnost vrijednosti standarda kvalitete i roka trajanja lijekova; - točnost i jednoznačnost korištenih pojmova, definicija, kemijske nomenklature i jedinica fizikalnih veličina.
 Sastavni dio kompleta dokumentacije koja se dostavlja Povjerenstvu za farmakopeju je kratka shema za sintezu lijekova s naznakom otapala koja se koriste u procesu sinteze, kao iu posljednjoj fazi pripreme i pročišćavanja. OFS, FS i FSP, nakon odobrenja, registriraju se u organizaciji ovlaštenoj za to od strane Ministarstva zdravstva Rusije, uz dodjelu oznake. Oznake OFS i FS sastoje se od skraćenog naziva kategorije standarda kvalitete lijeka, indeksa Ministarstva zdravstva Rusije, registracijskog broja dodijeljenog dokumentu i posljednje dvije znamenke godine odobrenja ili revizije, odvojene s crtica. Oznaka FSP, osim navedenih parametara, uključuje naznaku četveroznamenkaste šifre poduzeća prije registarskog broja dokumenta. Šifra poduzeća dodjeljuje se prilikom podnošenja zahtjeva za odobrenje prvog FSP-a. Izmjene i dopune standarda kvalitete lijekova svih kategorija provode se u slučajevima kada povećanje znanstvene i/ili tehnološke razine omogućuje poboljšanje kvalitete lijekova ili razjašnjavanje pokazatelja kvalitete.
Sastavni dio kompleta dokumentacije koja se dostavlja Povjerenstvu za farmakopeju je kratka shema za sintezu lijekova s naznakom otapala koja se koriste u procesu sinteze, kao iu posljednjoj fazi pripreme i pročišćavanja. OFS, FS i FSP, nakon odobrenja, registriraju se u organizaciji ovlaštenoj za to od strane Ministarstva zdravstva Rusije, uz dodjelu oznake. Oznake OFS i FS sastoje se od skraćenog naziva kategorije standarda kvalitete lijeka, indeksa Ministarstva zdravstva Rusije, registracijskog broja dodijeljenog dokumentu i posljednje dvije znamenke godine odobrenja ili revizije, odvojene s crtica. Oznaka FSP, osim navedenih parametara, uključuje naznaku četveroznamenkaste šifre poduzeća prije registarskog broja dokumenta. Šifra poduzeća dodjeljuje se prilikom podnošenja zahtjeva za odobrenje prvog FSP-a. Izmjene i dopune standarda kvalitete lijekova svih kategorija provode se u slučajevima kada povećanje znanstvene i/ili tehnološke razine omogućuje poboljšanje kvalitete lijekova ili razjašnjavanje pokazatelja kvalitete.
 Na primjer, FS 42 -000 056 - 01 označava: FS - standardna kategorija - farmakopejski članak; 42 - indeks Ministarstva zdravstva Rusije za označavanje standardizacijskih dokumenata; 000 056 - registarski broj dokumenta; 01 - zadnje dvije znamenke godine odobrenja (2001).
Na primjer, FS 42 -000 056 - 01 označava: FS - standardna kategorija - farmakopejski članak; 42 - indeks Ministarstva zdravstva Rusije za označavanje standardizacijskih dokumenata; 000 056 - registarski broj dokumenta; 01 - zadnje dvije znamenke godine odobrenja (2001).
 Standardizacijske metode Standardizacijska metoda je tehnika ili skup tehnika kojima se postižu ciljevi standardizacije. Univerzalna metoda u području normizacije proizvoda, procesa i usluga je naručivanje objekata normizacije kroz upravljanje raznolikošću. Sređivanje kao univerzalna metoda sastoji se od zasebnih metoda: sistematizacije, selekcije, pojednostavljenja, tipizacije i optimizacije.
Standardizacijske metode Standardizacijska metoda je tehnika ili skup tehnika kojima se postižu ciljevi standardizacije. Univerzalna metoda u području normizacije proizvoda, procesa i usluga je naručivanje objekata normizacije kroz upravljanje raznolikošću. Sređivanje kao univerzalna metoda sastoji se od zasebnih metoda: sistematizacije, selekcije, pojednostavljenja, tipizacije i optimizacije.
 Sistematizacija objekata normizacije sastoji se u znanstveno utemeljenoj, dosljednoj klasifikaciji i rangiranju skupa određenih objekata normizacije. Primjer rezultata rada na sistematizaciji proizvoda je Sveruski klasifikator proizvoda (OKP), koji sistematizira cjel utrživi proizvodi po djelatnostima u obliku raznih klasifikacijskih skupina i specifičnih naziva proizvoda.
Sistematizacija objekata normizacije sastoji se u znanstveno utemeljenoj, dosljednoj klasifikaciji i rangiranju skupa određenih objekata normizacije. Primjer rezultata rada na sistematizaciji proizvoda je Sveruski klasifikator proizvoda (OKP), koji sistematizira cjel utrživi proizvodi po djelatnostima u obliku raznih klasifikacijskih skupina i specifičnih naziva proizvoda.
 Odabir i siplifikacija objekata normizacije je aktivnost koja se sastoji u odabiru i identifikaciji specifičnih objekata koji su prepoznati kao prikladni za daljnju proizvodnju i uporabu (npr. stručni pregled MD, koji bi trebao biti uključen u listu vitalnih i esencijalnih lijekova). Paralelno se provode procesi selekcije i siplifikacije. Njima prethodi klasifikacija, rangiranje objekata, posebna analiza perspektive i usporedba objekata s budućim potrebama.
Odabir i siplifikacija objekata normizacije je aktivnost koja se sastoji u odabiru i identifikaciji specifičnih objekata koji su prepoznati kao prikladni za daljnju proizvodnju i uporabu (npr. stručni pregled MD, koji bi trebao biti uključen u listu vitalnih i esencijalnih lijekova). Paralelno se provode procesi selekcije i siplifikacije. Njima prethodi klasifikacija, rangiranje objekata, posebna analiza perspektive i usporedba objekata s budućim potrebama.
 Tipizacija objekata standardizacije je aktivnost izrade tipskih (uzornih) objekata, tehnološka pravila, obrasci dokumentacije. Optimizacija objekata normizacije sastoji se u pronalaženju optimalnih glavnih parametara (odredišnih parametara), kao i vrijednosti svih ostalih pokazatelja kvalitete i ekonomičnosti. Optimizacija objekata normizacije provodi se primjenom posebnih ekonomsko-matematičkih metoda i optimizacijskih modela. Cilj optimizacije je postizanje optimalnog stupnja uređenosti i najveće moguće učinkovitosti prema odabranom kriteriju.
Tipizacija objekata standardizacije je aktivnost izrade tipskih (uzornih) objekata, tehnološka pravila, obrasci dokumentacije. Optimizacija objekata normizacije sastoji se u pronalaženju optimalnih glavnih parametara (odredišnih parametara), kao i vrijednosti svih ostalih pokazatelja kvalitete i ekonomičnosti. Optimizacija objekata normizacije provodi se primjenom posebnih ekonomsko-matematičkih metoda i optimizacijskih modela. Cilj optimizacije je postizanje optimalnog stupnja uređenosti i najveće moguće učinkovitosti prema odabranom kriteriju.
 Standardni uzorci Prema namjeni razlikuju se sljedeće vrste usporednih uzoraka: - uzorci za ocjenu točnosti analize - koriste se za prosuđivanje ispravnosti, a ponekad i preciznosti analize; - kalibracijski uzorci koriste se u konstrukciji kalibracijske karakteristike; RM se, ovisno o namjeni primjene, dijele u skupine: 1. Državni etalonski uzorci (SRM); 2. Radni standardni uzorci (RSS); 3. Standardni uzorci tvari-svjedoci (SWS).
Standardni uzorci Prema namjeni razlikuju se sljedeće vrste usporednih uzoraka: - uzorci za ocjenu točnosti analize - koriste se za prosuđivanje ispravnosti, a ponekad i preciznosti analize; - kalibracijski uzorci koriste se u konstrukciji kalibracijske karakteristike; RM se, ovisno o namjeni primjene, dijele u skupine: 1. Državni etalonski uzorci (SRM); 2. Radni standardni uzorci (RSS); 3. Standardni uzorci tvari-svjedoci (SWS).
 GSO - posebno pripremljeni spojevi visok stupanjčistoće, čiji se standardni pokazatelji kakvoće odražavaju u FS-u i ispunjavaju zahtjeve WHO-a za ovaj RM. Koriste se za identifikaciju lijekova IC spektroskopijom, kromatografskim metodama, određivanje specifičnih nečistoća i kvantifikacija ljekovite tvari (tvari) HPLC-om, fotometrijom i UV spektrofotometrijom. Najčešće se koristi u ocjeni kvalitete ljekovitih tvari-supstance.
GSO - posebno pripremljeni spojevi visok stupanjčistoće, čiji se standardni pokazatelji kakvoće odražavaju u FS-u i ispunjavaju zahtjeve WHO-a za ovaj RM. Koriste se za identifikaciju lijekova IC spektroskopijom, kromatografskim metodama, određivanje specifičnih nečistoća i kvantifikacija ljekovite tvari (tvari) HPLC-om, fotometrijom i UV spektrofotometrijom. Najčešće se koristi u ocjeni kvalitete ljekovitih tvari-supstance.
 RSO - serijske ljekovite tvari koje udovoljavaju zahtjevima farmakopeje. Namijenjeni su za određivanje ljekovitih tvari fizikalno-kemijskim metodama u oblicima lijekova, pri čemu se CO u izračunima kvantitativnog sadržaja uzima kao 100%, kao i za provođenje pojedinačnih ispitivanja pri ocjeni kvalitete tvari. Koristi se za analizu oblika doziranja.
RSO - serijske ljekovite tvari koje udovoljavaju zahtjevima farmakopeje. Namijenjeni su za određivanje ljekovitih tvari fizikalno-kemijskim metodama u oblicima lijekova, pri čemu se CO u izračunima kvantitativnog sadržaja uzima kao 100%, kao i za provođenje pojedinačnih ispitivanja pri ocjeni kvalitete tvari. Koristi se za analizu oblika doziranja.
 Standardni uzorci tvari-svjedoci (SWS) - koriste se za određivanje nečistoća ili utvrđivanje komponentnog sastava lijekova. GSO RSO ili druge posebno proizvedene i certificirane tvari mogu se koristiti kao SSMS.
Standardni uzorci tvari-svjedoci (SWS) - koriste se za određivanje nečistoća ili utvrđivanje komponentnog sastava lijekova. GSO RSO ili druge posebno proizvedene i certificirane tvari mogu se koristiti kao SSMS.
 Standardni uzorci koriste se u sljedećim vrstama analitičkih tehnika: - IR spektroskopija za identifikaciju lijekova; - UV spektrofotometrija za kvantitativno određivanje; - kvantitativno određivanje na temelju mjerenja intenziteta boje; - metode kromatografske separacije za identifikaciju i kvantifikaciju; - kvantitativne metode, na temelju metoda odvajanja, ovisno o raspodjeli analita između faza otapala; - polarografske i polarimetrijske metode.
Standardni uzorci koriste se u sljedećim vrstama analitičkih tehnika: - IR spektroskopija za identifikaciju lijekova; - UV spektrofotometrija za kvantitativno određivanje; - kvantitativno određivanje na temelju mjerenja intenziteta boje; - metode kromatografske separacije za identifikaciju i kvantifikaciju; - kvantitativne metode, na temelju metoda odvajanja, ovisno o raspodjeli analita između faza otapala; - polarografske i polarimetrijske metode.
 Uvođenje RM u praksu farmaceutske analize omogućuje postizanje niza pozitivnih rješenja: 1. Primjena najnovije metode istraživanje. 2. Osigurati ujednačenost mjerenja. Poznato je da rezultati analize istog lijeka, provedeni na različitim instrumentima, koji se razlikuju po osjetljivosti i rezoluciji, mogu dati značajna odstupanja. Utjecaj instrumentalne pogreške moguće je isključiti pomoću RM, budući da je sadržaj tvari u standardima poznat, a određivanje se svodi na usporedbu analiziranog pripravka sa standardom pod istim uvjetima. 3. Pojednostaviti i ubrzati mjerenja, što proizlazi iz prethodnog.
Uvođenje RM u praksu farmaceutske analize omogućuje postizanje niza pozitivnih rješenja: 1. Primjena najnovije metode istraživanje. 2. Osigurati ujednačenost mjerenja. Poznato je da rezultati analize istog lijeka, provedeni na različitim instrumentima, koji se razlikuju po osjetljivosti i rezoluciji, mogu dati značajna odstupanja. Utjecaj instrumentalne pogreške moguće je isključiti pomoću RM, budući da je sadržaj tvari u standardima poznat, a određivanje se svodi na usporedbu analiziranog pripravka sa standardom pod istim uvjetima. 3. Pojednostaviti i ubrzati mjerenja, što proizlazi iz prethodnog.
 Uvođenjem RM u praksu farmaceutske analize moguće je postići niz pozitivnih rješenja: 4. Povećati točnost i pouzdanost analitičkih metoda. 5. Razviti metode automatske kontrole kvalitete. 6. Ostvariti ispravnost rezultata mjerenja veličina koje karakteriziraju sastav i svojstva tvari i mogućnost pouzdanog umjeravanja analitičkih instrumenata.
Uvođenjem RM u praksu farmaceutske analize moguće je postići niz pozitivnih rješenja: 4. Povećati točnost i pouzdanost analitičkih metoda. 5. Razviti metode automatske kontrole kvalitete. 6. Ostvariti ispravnost rezultata mjerenja veličina koje karakteriziraju sastav i svojstva tvari i mogućnost pouzdanog umjeravanja analitičkih instrumenata.
 Referentni uzorak je tvar koja se koristi za osiguranje kvalitete mjerenja (umjeravanje, certificiranje metoda, ocjena statističkih karakteristika mjernog procesa i sl.) Usporedne uzorke možemo uvjetno podijeliti na usporedne uzorke jednostavnog i složenog sastava.
Referentni uzorak je tvar koja se koristi za osiguranje kvalitete mjerenja (umjeravanje, certificiranje metoda, ocjena statističkih karakteristika mjernog procesa i sl.) Usporedne uzorke možemo uvjetno podijeliti na usporedne uzorke jednostavnog i složenog sastava.
 Usporedni uzorci jednostavnog sastava su čiste tvari i njihove otopine. Usporedni uzorci složenog sastava nazivaju se višekomponentni uzorci koji su po sastavu i svojstvima bliski rutinskim uzorcima. Pripremaju se na temelju tvari iste prirode s rutinskim uzorcima.
Usporedni uzorci jednostavnog sastava su čiste tvari i njihove otopine. Usporedni uzorci složenog sastava nazivaju se višekomponentni uzorci koji su po sastavu i svojstvima bliski rutinskim uzorcima. Pripremaju se na temelju tvari iste prirode s rutinskim uzorcima.

 Stabilnost referentnih uzoraka leži u činjenici da promjena utvrđenih parametara (koncentracije analita) od trenutka ovjere do trenutka uporabe treba biti mala u odnosu na pogrešku referentnog uzorka. Često je potrebno posebno rukovanje kako bi se osigurala stabilnost. Na primjer, otopinama organskih tvari dodaju se tvari koje sprječavaju njihovu oksidaciju i imaju baktericidna svojstva (otopina glukoze stabilizirana je benzojevom kiselinom); tekućine su hermetički zatvorene kako bi se izbjeglo isparavanje (zalemljene u ampule); nestabilni uzorci se pohranjuju i šalju na niskoj temperaturi, liofiliziraju itd.
Stabilnost referentnih uzoraka leži u činjenici da promjena utvrđenih parametara (koncentracije analita) od trenutka ovjere do trenutka uporabe treba biti mala u odnosu na pogrešku referentnog uzorka. Često je potrebno posebno rukovanje kako bi se osigurala stabilnost. Na primjer, otopinama organskih tvari dodaju se tvari koje sprječavaju njihovu oksidaciju i imaju baktericidna svojstva (otopina glukoze stabilizirana je benzojevom kiselinom); tekućine su hermetički zatvorene kako bi se izbjeglo isparavanje (zalemljene u ampule); nestabilni uzorci se pohranjuju i šalju na niskoj temperaturi, liofiliziraju itd.
 Stabilnost referentnih uzoraka obično se izražava u obliku njegovog vijeka trajanja - vremena tijekom kojeg pogreška povezana s nestabilnošću ne prelazi prihvatljivu vrijednost. Homogenost (homogenost) referentnih uzoraka je svojstvo izraženo u stalnosti koncentracije analita. Adekvatnost se obično zahtijeva za usporedne uzorke složenog sastava i leži u činjenici da su analitički bliski rutinskim uzorcima.
Stabilnost referentnih uzoraka obično se izražava u obliku njegovog vijeka trajanja - vremena tijekom kojeg pogreška povezana s nestabilnošću ne prelazi prihvatljivu vrijednost. Homogenost (homogenost) referentnih uzoraka je svojstvo izraženo u stalnosti koncentracije analita. Adekvatnost se obično zahtijeva za usporedne uzorke složenog sastava i leži u činjenici da su analitički bliski rutinskim uzorcima.
 Kontrolni i arhivski uzorci Prisutnost kontrolnih i arhivskih uzoraka nužna je u dvije svrhe: 1. kako bi se osigurala dostupnost uzorka za analitičke studije; 2. Kako bi se osiguralo da je uzorak potpun Gotovi proizvodi.
Kontrolni i arhivski uzorci Prisutnost kontrolnih i arhivskih uzoraka nužna je u dvije svrhe: 1. kako bi se osigurala dostupnost uzorka za analitičke studije; 2. Kako bi se osiguralo da je uzorak potpun Gotovi proizvodi.
 Kontrolni uzorak je uzorak uzet iz serije sirovina, materijala za pakiranje ili gotovih proizvoda, koji se po potrebi čuva za analizu tijekom isteka roka trajanja serije. Uzorci uzeti u kritičnim međufazama (na primjer, nakon kojih se očekuju analitičke studije i odobrenja za puštanje u promet) i uzorci međuproizvoda koji se isporučuju izvan kontrolnog područja proizvođača trebaju se zadržati, ako to dopušta stabilnost uzoraka. Dizajniran za analizu i trebao bi biti lako dostupan laboratoriju koji ima validirane metode za izvođenje takve analize. Broj kontrolnih uzoraka treba biti dovoljan za provođenje najmanje dva kompletna analitička kontrola serija proizvoda u skladu sa zahtjevima utvrđenim tijekom državne registracije. Pohranjivanje kontrolnih uzoraka gotovih proizvoda i farmaceutskih tvari treba provoditi u skladu sa zahtjevima regulatornih pravnih akata Ruske Federacije. Uvjeti skladištenja moraju biti u skladu sa zahtjevima utvrđenim tijekom državne registracije lijeka (na primjer, skladištenje na niskoj temperaturi, ako je potrebno).
Kontrolni uzorak je uzorak uzet iz serije sirovina, materijala za pakiranje ili gotovih proizvoda, koji se po potrebi čuva za analizu tijekom isteka roka trajanja serije. Uzorci uzeti u kritičnim međufazama (na primjer, nakon kojih se očekuju analitičke studije i odobrenja za puštanje u promet) i uzorci međuproizvoda koji se isporučuju izvan kontrolnog područja proizvođača trebaju se zadržati, ako to dopušta stabilnost uzoraka. Dizajniran za analizu i trebao bi biti lako dostupan laboratoriju koji ima validirane metode za izvođenje takve analize. Broj kontrolnih uzoraka treba biti dovoljan za provođenje najmanje dva kompletna analitička kontrola serija proizvoda u skladu sa zahtjevima utvrđenim tijekom državne registracije. Pohranjivanje kontrolnih uzoraka gotovih proizvoda i farmaceutskih tvari treba provoditi u skladu sa zahtjevima regulatornih pravnih akata Ruske Federacije. Uvjeti skladištenja moraju biti u skladu sa zahtjevima utvrđenim tijekom državne registracije lijeka (na primjer, skladištenje na niskoj temperaturi, ako je potrebno).
 Arhivski uzorak - uzorak u konačnom pakiranju, odabran iz niza gotovih proizvoda, koji se pohranjuje u svrhu potvrde identiteta. Primjerice, tijekom roka valjanosti serije može biti potrebno pregledati uzorak ili pakiranje, označavanje, upute za uporabu, dobiti podatke o broju serije i roku valjanosti. Arhivski uzorci moraju predstavljati niz gotovih lijekova u obliku u kojem se prodaju u Ruskoj Federaciji i mogu se koristiti za kontrolu kako bi se potvrdila usklađenost sa zahtjevima utvrđenim tijekom državne registracije. Arhivske uzorke preporuča se pohraniti na mjestu gdje se nalazi ovlaštena osoba koja je izdala dozvolu za puštanje proizvoda u promet.
Arhivski uzorak - uzorak u konačnom pakiranju, odabran iz niza gotovih proizvoda, koji se pohranjuje u svrhu potvrde identiteta. Primjerice, tijekom roka valjanosti serije može biti potrebno pregledati uzorak ili pakiranje, označavanje, upute za uporabu, dobiti podatke o broju serije i roku valjanosti. Arhivski uzorci moraju predstavljati niz gotovih lijekova u obliku u kojem se prodaju u Ruskoj Federaciji i mogu se koristiti za kontrolu kako bi se potvrdila usklađenost sa zahtjevima utvrđenim tijekom državne registracije. Arhivske uzorke preporuča se pohraniti na mjestu gdje se nalazi ovlaštena osoba koja je izdala dozvolu za puštanje proizvoda u promet.
 U mnogim slučajevima kontrolni i arhivski uzorci gotovih proizvoda su identični i jedinice su proizvodnje u konačnom pakiranju. U takvim slučajevima kontrolni i arhivski uzorci mogu se smatrati međusobno zamjenjivima. Kontrolni i arhivski uzorci karakteriziraju seriju gotovih proizvoda ili sirovina i materijala, prilog su dosjeu za seriju i mogu se ocjenjivati u slučaju tvrdnji o kvaliteti lijeka, provjere sukladnosti sa zahtjevima utvrđenim tijekom državna registracija, provjera označavanja i pakiranja ili provjera od strane ovlaštenog saveznog tijela izvršne vlasti (inspektorata).
U mnogim slučajevima kontrolni i arhivski uzorci gotovih proizvoda su identični i jedinice su proizvodnje u konačnom pakiranju. U takvim slučajevima kontrolni i arhivski uzorci mogu se smatrati međusobno zamjenjivima. Kontrolni i arhivski uzorci karakteriziraju seriju gotovih proizvoda ili sirovina i materijala, prilog su dosjeu za seriju i mogu se ocjenjivati u slučaju tvrdnji o kvaliteti lijeka, provjere sukladnosti sa zahtjevima utvrđenim tijekom državna registracija, provjera označavanja i pakiranja ili provjera od strane ovlaštenog saveznog tijela izvršne vlasti (inspektorata).
 Proizvođač, uvoznik ili poduzeće u kojem je izdano dopuštenje za puštanje serije mora čuvati kontrolne i (ili) arhivske uzorke svake serije gotovih proizvoda, proizvođač - kontrolne uzorke svake serije sirovina i (ili) poluproizvoda. Na svaki mjesto proizvodnje tvrtka za pakiranje mora čuvati kontrolne uzorke svake serije primarne materijali za pakiranje i tiskani materijali. Dopušteno je uključiti tiskane materijale u sastav kontrolnih i (ili) arhivskih uzoraka gotovih proizvoda.
Proizvođač, uvoznik ili poduzeće u kojem je izdano dopuštenje za puštanje serije mora čuvati kontrolne i (ili) arhivske uzorke svake serije gotovih proizvoda, proizvođač - kontrolne uzorke svake serije sirovina i (ili) poluproizvoda. Na svaki mjesto proizvodnje tvrtka za pakiranje mora čuvati kontrolne uzorke svake serije primarne materijali za pakiranje i tiskani materijali. Dopušteno je uključiti tiskane materijale u sastav kontrolnih i (ili) arhivskih uzoraka gotovih proizvoda.
 Kontrolni i arhivski uzorci svake serije gotovih proizvoda moraju se čuvati najmanje do isteka roka valjanosti serije i godinu dana nakon isteka roka valjanosti. Kontrolni uzorak mora biti pakiran u originalnom pakiranju. Uzorci sirovina (osim otapala, plinova ili vode namijenjenih za tehnološke svrhe) moraju se čuvati najmanje dvije godine nakon puštanja lijeka u promet, osim ako je dulje razdoblje predviđeno odgovarajućim regulatornim pravnim aktima Ruske Federacije. .
Kontrolni i arhivski uzorci svake serije gotovih proizvoda moraju se čuvati najmanje do isteka roka valjanosti serije i godinu dana nakon isteka roka valjanosti. Kontrolni uzorak mora biti pakiran u originalnom pakiranju. Uzorci sirovina (osim otapala, plinova ili vode namijenjenih za tehnološke svrhe) moraju se čuvati najmanje dvije godine nakon puštanja lijeka u promet, osim ako je dulje razdoblje predviđeno odgovarajućim regulatornim pravnim aktima Ruske Federacije. .
Predmet normizacije u oblasti prometa lijekova su lijekovi i djelatnosti koje se odnose na:
organizacija kontrole proizvodnje i kakvoće lijekova;
proces organiziranja opskrbe lijekovima na saveznoj i regionalnoj razini;
proizvodnja lijekova u ljekarnama;
procesi koji se odvijaju u mreži distribucije robe;
informacije o lijekovima za potrošače;
opskrba lijekovima u sustavu zdravstvene ustanove;
racionalnu upotrebu lijekova, kao i djelatnost ljekarni.
Organizacija proizvodnje i kontrole kvalitete lijekova regulirana je industrijskim standardom OST 42-510-98 - to su Pravila za organizaciju proizvodnje i kontrole kvalitete lijekova (GMP) (odobrena od strane Ministarstva zdravstva Ruske Federacije 25. veljače 1998.).
Dokument je skup pravila i zahtjeva za organizaciju proizvodnje i kontrolu kvalitete lijekova za medicinske potrebe. Glavne odredbe odnose se i na posljednje faze proizvodnje ljekovitih tvari namijenjenih proizvodnji gotovih lijekova. U potpunosti, zahtjevi za proizvodnju ljekovitih tvari, kao i određene skupine lijekova, utvrđeni su posebnim regulatornim dokumentima. Pravila su obvezna za sve proizvođače lijekova, bez obzira na podređenost odjela ili oblik vlasništva.
Standardizacija lijekova glavni je jamac njihove visoke kvalitete u masovnoj proizvodnji te osigurava učinkovitost i sigurnost uporabe. Osnova sustava upravljanja kvalitetom lijekova je normizacija.
Certificiranje medicinskih sirovina i proizvoda provodi se u skladu s pravilima za certificiranje u sustavu certificiranja lijekova GOST RF sustava certificiranja. Ovim se Pravilnikom utvrđuju temeljna načela i zahtjevi koji se odnose na postupak certificiranja registriranih na području Ruska Federacija lijekova domaće i inozemne proizvodnje radi zaštite prava i interesa potrošača i provođenja jedinstvene državne politike u području opskrbe stanovništva kvalitetnim i sigurnim lijekovima:
I. Postupak certifikacije domaćih i stranih lijekova
II. Zahtjevi za certifikacijska tijela
III. Zahtjevi za kontrolne laboratorije
IV. Vođenje Državnog registra sudionika u certificiranju lijekova
Stvaranje regulatorni okvir na ovom području provodi zadaće opskrbe stanovništva sigurnim, učinkovitim i kvalitetnim lijekovima. Opskrba lijekovima sastoji se od razvoja, ispitivanja, registracije, proizvodnje i prodaje lijekova.
Zahtjevi za razvoj novih lijekova uključuju regulaciju tehnologije razvoja lijekova, njihova pretklinička i klinička ispitivanja, pravila registracije.
Uvjeti za promet lijekova uređuju uvjete skladištenja, prijevoza, certificiranja, prometa na veliko i maloprodaja, opskrba medicinskih ustanova lijekovima, izdavanje pacijentima. Primjer je naredba Moskovskog odjela za zdravstvo br. 257 od 25. svibnja 2004. o postupku nabave, prijevoza, skladištenja, računovodstva, izdavanja, uporabe opojnih droga, psihotropnih tvari uključenih u Popis II i psihotropnih tvari uključenih u Popis III, u skladu sa saveznim zakonom "O droge i psihotropne tvari» u medicinskim i preventivnim ustanovama Moskovskog odjela za zdravstvo.
država centralizirani sustav opskrba lijekovima u SSSR-u osiguravala je određenu razinu farmaceutske pomoći stanovništvu putem strogih uprave. Zbog prisutnosti vertikalnog upravljanja sustavom opskrbe lijekovima i homogenosti veleprodaje i maloprodaja Kvaliteta opskrbe lijekovima mogla bi se regulirati naredbama, uputama i cirkularnim pismima. Istovremeno, nedostatak fleksibilnosti karakterističan za plansku regulaciju negativno je utjecao na kvalitetu opskrbe stanovništva lijekovima.
značajka moderna pozornica razvojem farmaceutskog tržišta treba smatrati pojavu ljekarničkih lanaca, formiranih, u pravilu, veletrgovci raznih oblika vlasništva ili, mnogo rjeđe, ruskih proizvođača.
Budući da je opskrba lijekovima sastavni dio cjelokupne sfere prometa lijekova i neraskidivo je povezana s državnim sustavom kontrole kvalitete, pitanja standardizacije treba rješavati zajedno s poboljšanjem sustava kontrole kvalitete lijekova.
Medicinska pomoć građanima provodi se na temelju uvjeta za ispunjavanje medicinske usluge. Formiranje regulatornih dokumenata koji omogućuju organiziranje opskrbe lijekovima temelji se na minimalnim zahtjevima protokola za dijagnozu i liječenje bolesti. Ti dokumenti uključuju:
Popis vitalnih i esencijalnih lijekova.
Savezne smjernice za liječnike o uporabi lijekova.
Popis povlaštenog puštanja u promet lijekova.
Popis lijekova koji se izdaju bez liječničkog recepta.
Formular popisa lijekova subjekta Ruske Federacije.
Formularni popis zdravstvenih ustanova.
Obavezni asortiman lijekova za ambulantne ljekarne.
Važno je pitanje osigurati kvalitetu informacija o lijekovima. Kako bi se riješio ovaj problem, razvijen je i implementiran industrijski standard 91500.05.0002-2001 "Državni informacijski standard o medicinskom proizvodu. Osnovne odredbe" (OST GISLS).
Državni informacijski standard o lijeku uključuje sljedeće strukturne elemente:
- – farmakopejski članak o lijeku;
- - unos lijeka u formular;
- - klinički i farmakološki članak;
- - putovnica lijeka.
Odobreni službeni registracijski dokumenti koji identificiraju lijek:
1. Potvrda o registraciji - regulatorni dokument koji potvrđuje činjenicu službenog dopuštenja za promet ovog lijeka na području Ruske Federacije.
Sadrži podatke o registraciji lijeka za sljedeće stavke:
- - Matični broj;
- - Datum registracije;
- - trgovački naziv;
- - INN ili naziv koji ga na propisani način zamjenjuje;
- - poduzeće - proizvođač;
- - država poduzeća - proizvođača;
- - oblik doziranja;
- - doziranje;
- - FSP broj.
Potvrda o registraciji - služi kao temelj za uvrštenje lijeka u Državni registar lijekovi.
2. Dokaz o registraciji jedinstvenog broja pakiranja lijeka - digitalna oznaka(kod) u standardu Međunarodnog udruženja robnih brojeva EAN (UNISCAN), koji ima odgovarajući grafički prikaz (bar kod), omogućuje njegovo automatizirano očitavanje i jednoznačnu identifikaciju. 13-bitni digitalni kod - u obliku kombinacije poteza i razmaka različitih širina - uključuje kodove: države, tvrtke koja je kodirala proizvod, samog proizvoda i kontrolnog broja.
Regulatorni dokumenti koji reguliraju sferu prometa lijekova razvijaju se na temelju informacija sadržanih u državnom informacijskom standardu o lijeku. Sukladnost s GISLS-om je kriterij za pouzdanost informacija o lijeku.
Na temelju informacija sadržanih u GISLS-u, sljedeće propisi:
Državni registar lijekova - sistematizirani popis naziva i glavnih karakteristika lijekova, lijekova odobrenih za uporabu u Ruskoj Federaciji;
Uputa za uporabu lijeka - službeni dokument koji sadrži podatke o lijeku koji su potrebni i dostatni za njegovu učinkovitu i sigurnu medicinsku primjenu;
Popis vitalnih i esencijalnih lijekova - sustavan popis generičkih naziva lijekova, uključujući i lijekove bez čije primjene, prema procjenama stručnjaka, kod bolesti i sindroma opasnih po život dolazi do progresije bolesti ili pogoršanja tijeka, komplikacija ili smrti bolesnika pojavit će se, kao i lijekovi za specifičnu terapiju društveno značajnih bolesti;
Savezne smjernice za liječnike o uporabi lijekova - zbirka formularnih članaka lijekova ili njihovih fragmenata uključenih u popis vitalnih i esencijalnih lijekova s opisom shema i značajki njihove uporabe u određenoj bolesti (sindromu);
Popis preferencijalnih izdavanja lijekova - dokument koji je odobrila lokalna izvršna vlast konstitutivnog entiteta Ruske Federacije, koji sadrži zajamčeni raspon koncesivnih lijekova za izvanbolničko liječenje;
Popis lijekova koji se izdaju bez liječničkog recepta - regulatorni dokument koji sadrži popis naziva lijekova koji se izdaju bez liječničkog recepta;
Formular popisa lijekova konstitutivnog entiteta Ruske Federacije - dokument koji sadrži popis naziva lijekova koji se preporučuju za upotrebu na području konstitutivnog entiteta Ruske Federacije;
Formularni popis zdravstvene ustanove - dokument koji sadrži popis naziva lijekova preporučenih za uporabu u zdravstvenoj ustanovi;
Obvezni asortiman lijekova za ambulantne ljekarne - regulatorni dokument koji uređuje minimalni asortiman lijekova potrebnih za pružanje medicinska pomoć, čija je prisutnost obavezna za ljekarničku organizaciju koja poslužuje ambulantne pacijente.
Za sustavan rad na stvaranju sustava regulatornih dokumenata u području opskrbe lijekovima i uvođenju standarda u praksu potrebno je koordinirati rad na normizaciji kako u području prometa lijekova tako iu zdravstvu općenito. U tom poslu trebaju aktivno sudjelovati specijalizirane znanstvene institucije, farmaceutska i medicinska zajednica.
Poglavlje 13 Normizacija, struktura norme i postupak odobravanja, registracija, licenciranje i certifikacija
U OST 91500.05.001-2000. Farmaceutski standardi kvalitete. Opće odredbe definiran je jedinstveni postupak izrade, prezentacije, provedbe, ispitivanja, odobravanja, odobravanja i označavanja standarda kvalitete lijekova.
Shema za provedbu zahtjeva OST-a o osiguravanju državne kontrole kvalitete lijekova prikazana je na sl. 13.1.
Ovaj OST također definira da državni standardi kvalitete za lijekove nose opći naziv "članak iz farmakopeje" i dolaze u sljedećim kategorijama:
Opća farmakopejska monografija (GPM)- sadrži popis normaliziranih pokazatelja ili metoda ispitivanja za određeni oblik lijeka, opis fizikalnih, fizikalno-kemijskih, kemijskih, biokemijskih, bioloških, mikrobioloških metoda za analizu lijekova, zahtjeve za korištene reagense, titrirane otopine, indikatore.
Članak iz farmakopeje (FS) je razvijen za lijek pod međunarodnim nezaštićenim nazivom, ako je dostupan (za monokomponentne lijekove) i sadrži obvezni popis pokazatelja i metoda kontrole kvalitete (uzimajući u obzir njegov oblik doziranja) koji su u skladu s odredbama vodećih strane farmakopeje.
Izrada farmakopejske monografije za originalni (zaštićeni) lijek tijekom trajanja patentne zaštite i njegovo uvrštavanje u Državnu farmakopeju moguća je samo uz dogovor s razvojnim proizvođačem lijeka ili se provodi nakon isteka patenta.
Riža. 13.1. Shema za provedbu zahtjeva OST-a kako bi se osigurala državna kontrola kvalitete lijekova (prema Bagirova V.L.)
Farmakopejski članak za lijek određenog poduzeća (FSP) uključuje popis standardiziranih pokazatelja i metoda kontrole kvalitete za lijekove koje proizvodi određeno poduzeće, uzimajući u obzir zahtjeve Državne farmakopeje. Štoviše, normalizirani pokazatelji ne bi trebali biti niži od zahtjeva utvrđenih Državnom farmakopejom. Razdoblje valjanosti FSP-a utvrđuje se uzimajući u obzir razinu tehnološkog procesa određene proizvodnje lijeka, ali ne više od 5 godina.
Opće monografije i farmakopejski članci za pojedine lijekove konstituirati Državna farmakopeja (GF), koji mora objaviti nadležna savezna agencija i ponovno objaviti svakih pet godina.
Trenutno je Državna farmakopeja SSSR-a XI izdanje nacionalni standard u Rusiji. Pripreme za izlazak GF XII izdanja.
Jedan od glavnih međunarodnih standarda za lijekove uveden je 1996. Europska farmakopeja, koji je osmišljen kako bi osigurao javno zdravlje stanovništva stvaranjem javnih standarda koji reguliraju kvalitetu lijekova.
Članovi SZO mogu koristiti Međunarodna farmakopeja, koji regulira prihvatljive standarde za snagu, čistoću i kvalitetu farmaceutskih proizvoda koji ulaze na međunarodno tržište. Posebnost ove norme od nacionalnih farmakopeja je korištenje metoda razvijenih na temelju klasičnih metoda za kontrolu kvalitete lijekova. To ih čini dostupnima i zemljama u razvoju. Metode su jednostavne za implementaciju i ne zahtijevaju velike materijalne troškove.
13.1. Struktura i sadržaj standarda za lijekove i ljekovite biljne sirovine
Kako je već spomenuto, farmakopejski članci su standardi kvalitete za tvari, lijekove i ljekovite biljne sirovine. Izuzetak su ljekovite biljne sirovine (angro), za koje je povijesno uobičajeno formulirati standarde kvalitete u obliku GOST-a.
13.1.1 Opći zahtjevi na strukturu i sadržaj farmakopejskih monografija
Opći zahtjevi za strukturu i sadržaj farmakopejskih monografija za tvari, lijekove i pakirane ljekovite biljne sirovine su sljedeći:
1. Naziv proizvoda na ruskom jeziku naveden je u naslovu standarda.
U nazivu proizvoda prva riječ treba biti naziv djelatne tvari (u nominativu) ili trgovački naziv (u nominativu), a zatim naziv oblika lijeka, doza (koncentracija), volumen . Na primjer: Analgin tablete 0,5 g ili Analgin injekcije 25%.
Popis glavnih odjeljaka FS i FSP i redoslijed njihove prezentacije određen je određenim oblikom doziranja.
Svi pokazatelji kvalitete proizvoda sadržani u FSP moraju biti prikazani u zbirnoj tablici (specifikaciji). Specifikacija je obvezni dio FSP-a.
Numeriranje odjeljaka OFS-a, FS-a i FSP-a nije navedeno.
Izlaganje teksta treba biti kratko, bez ponavljanja i treba isključiti mogućnost različitih tumačenja.
Kratice riječi u tekstu i natpisi ispod slika, dijagrama i drugih ilustracija nisu dopuštene, s izuzetkom kratica koje se koriste u zakonodavstvu Ruske Federacije.
U tekstualnom dijelu standarda zahtjevi za kvalitetu robe navedeni su u imperativnom obliku.
Prilikom predstavljanja obveznih zahtjeva, normi i metoda u tekstu, riječi mora, treba, mora i izvedenice iz njih.
Naslovi odjeljaka nalaze se na crvenoj liniji i podebljani su ili podcrtani.
Ako su zahtjevi, norme, metode itd., primjenjivi na lijek, utvrđeni u Državnoj farmakopeji, drugim državnim ili industrijskim standardima, tada umjesto ponavljanja njihovog teksta treba navesti poveznicu na izvor.
Prikaz teksta o tvari koja se koristi u proizvodnji lijeka mora biti popraćen pozivom na regulatorni dokument prema kojem se proizvodi.
Pri opisu sastava lijeka kvantitativni sadržaj aktivnih djelatnih tvari i kvalitativni sastav pomoćnih tvari navedeni su u obliku popisa s pozivom na odgovarajuću regulatornu dokumentaciju koja sadrži zahtjeve za njihovu kakvoću.
U poglavlju " Opis» utvrđivanje organoleptičkih pokazatelja izgled gotov lijek (boja, miris). Ne treba koristiti definiciju: azur, jaje itd. Glavna boja se nalazi na kraju definicije.
U poglavlju "raspad" naznačeno je vrijeme potpunog raspadanja tablete ili kapsule u tekućem mediju (pod uvjetima navedenim u Državnoj farmakopeji).
Poglavlje " Autentičnost» sadrži metode za utvrđivanje autentičnosti djelatne tvari i proizvoda u cjelini. Za pripravke složenog sastava, nakon opisa potrebne definicije, u zagradi se navodi identificirani sastojak.
Sekcije "Transparentnost" i " Chroma» utvrditi prozirnost (mutnoću) i boju proizvoda u usporedbi s otapalom ili odgovarajućim standardom.
Poglavlje " kiselost, alkalnost" ili "pH" regulira ove pokazatelje.
Sekcije"Suhi ostatak", "Sadržaj alkohola", "Vrelište", "Gustoća", "Indeks loma", "Kut rotacije", "Viskoznost" gornje i donje granice ovih standardnih pokazatelja naznačene su u odgovarajućim mjernim jedinicama.
Poglavlje " Otapanje" određuje količinu djelatne tvari, koja u danim uvjetima mora prijeći u otopinu određeno vrijeme.
U poglavlju " Kvantifikacija» opisuje metodu kvantitativnog određivanja glavne tvari sadržane u lijeku. Ovaj odjeljak također pokazuje postotak glavne tvari ili aktivnosti u jedinicama djelovanja (U / mg) ili mikrogramima po miligramu (µg / mg) u smislu djelatne tvari u lijeku ili njegovim oblicima doziranja.
Za tablete su naznačene granice sadržaja glavne tvari u gramima u jednoj tableti, računajući na prosječnu težinu tablete, u čepićima - u gramima po svijeći, u pilulama - u gramima po piluli, u otopinama za injekcije - u grama po 1 ml.
Međutim, struktura i sadržaj PS i PhSP za svaku vrstu farmaceutskog proizvoda ima svoje karakteristike. Budući da farmaceut, glavna i viša medicinska sestra u svom djelovanju moraju znati koristiti ove standarde prilikom preuzimanja robe, a studenti Fakulteta za sestrinstvo ni u jednom kolegiju ne uče niti rade s ovim regulatornim dokumentima, zadržat ćemo se na njihovoj strukturi. i sadržaj detaljnije.
13.12. Struktura i sadržaj državnih standarda kakvoće tvari
Farmakopejska monografija za tvar ima sljedeću strukturu i sadržaj:
Naziv tvari na ruskom
Međunarodni nezaštićeni naziv (INN) na ruskom
Kemijski naziv u skladu sa zahtjevima Međunarodne unije za čistu i primijenjenu kemiju – IUPAC).
Strukturne i empirijske formule.
Relativna molekularna težina.
Opis (pokazatelji izgleda tvari: agregatno stanje, boja, miris, higroskopnost, osjetljivost na svjetlo i plin).
Autentičnost (karakteristike UV i IR apsorpcijskih spektara, specifične kvalitativne reakcije i dr.).
Topljivost (pokazatelji topljivosti u vodi, 95% alkoholu, kloroformu, eteru, drugim otapalima, omjer mase otopljene tvari i volumena otapala).
Temperature taljenja, skrućivanja, vrenja, raspadanja.
Gustoća.
specifična rotacija.
Specifična stopa apsorpcije.
indeks loma.
Prozirnost i boja otopine (označava se za otopine određene koncentracije; za obojene otopine označava se broj standarda boje i slovo ljestvice, karakteristike apsorpcijskih spektara otopina).
Kiselost i lužnatost (pH se određuje potenciometrijskom metodom pomoću 0,01-ONE kiselina ili lužina uz korištenje odgovarajućih indikatora).
mehaničke inkluzije.
Strane nečistoće, indikatori čistoće, zaostala organska otapala, sulfatni pepeo, teški metali, arsen (metode detekcije, dopuštene razine nečistoća koje ulaze u tvar tijekom njezine proizvodnje ili nastaju tijekom skladištenja).
Gubitak sušenjem, voda (metoda provođenja studije prema K. Fischeru, norme za gubitak mase sušenjem ili sadržaj vlage).
Toksičnost, pirogenost, sadržaj tvari sličnih histaminu (ispitivane doze, način primjene i razdoblje promatranja za ispitivane tvari).
Mikrobiološka čistoća, sterilnost (metoda određivanja mikroorganizama, njihove dopuštene granice).
Kvantitativno određivanje glavne aktivne tvari (njezin % sadržaj ili aktivnost u jedinicama / mg).
Pakiranje (vrsta primarne ambalaže, broj jedinica proizvoda u primarnoj ambalaži, sekundarnoj ambalaži, broj primarnih ambalaža u njoj, načini pečaćenja; dane su poveznice na regulatorne dokumente koji određuju vrste i kvalitetu skupne i transportne ambalaže itd.).
Označavanje (u skladu sa zahtjevima za grafičko oblikovanje lijekova).
Skladištenje (navedeni su uvjeti skladištenja proizvoda, ako je potrebno, zahtjevi za zaštitu proizvoda od utjecaja klimatskih čimbenika).
Rok trajanja (razdoblje tijekom kojeg se tvar može koristiti).
Farmakološko, biološko djelovanje (farmakološka skupina kojoj je tvar pripisana).
Mjere opreza.
Naziv tvari.
Uvodni dio.
Glavni dio.
Istodobno, klauzule 1.1 - 1.3, 2.1, 2.3, 3.1-3.3, 3.13, 3.15-3.22 su obvezne. Uključivanje ostalih stavki ovisi o prirodi ljekovite tvari (tvari), tehnologiji njezine proizvodnje i oblicima doziranja koji će se iz te tvari izrađivati.
13.1.3. Struktura i sadržaj državnih standarda kakvoće lijekova
Farmakopejski članak za lijekove ima sljedeću strukturu i sadržaj:
Kemijski naziv djelatne tvari (za pakirane ljekovite biljne sirovine - ruski i latinski naziv biljnih sirovina; za ekstrakte - biljka od koje je sirovina napravljena i njezina porodica.
Sastav lijeka, s naznakom kvantitativnog sadržaja aktivnih aktivnih tvari.
Sastav pomoćnih tvari (kvalitativni).
Opis (organoleptički pokazatelji izgleda lijeka).
Autentičnost (karakteristike UV i IR apsorpcijskih spektara, specifične kvalitativne reakcije i dr.).
Raspad (vrijeme potpunog raspadanja tablete, kapsule u tekućem mediju).
Prozirnost, boja (prozirnost, mutnoća, boja lijeka u odnosu na otapalo ili standard).
Kiselost, lužnatost (pH, određen potenciometrijski, pomoću 0,01-0,1 N kiselina ili lužina, pomoću odgovarajućih indikatora).
Suhi ostatak, sadržaj alkohola, vrelište, gustoća, indeks loma, specifična rotacija, viskoznost (gornja i donja granica navedenih pokazatelja).
Otapanje (količina djelatne tvari koja mora u odgovarajućim uvjetima i kroz određeno vrijeme prijeći u otopinu).
Kvantitativno određivanje (metoda kvantitativnog određivanja glavne tvari sadržane u lijeku, % sadržaja glavne tvari ili aktivnosti u U / mg, μg / mg u odnosu na djelatnu tvar; granični sadržaj glavne tvari: za tablete - u gramima u jednoj tableti, za supozitorije - u gramima po 1 supozitoriju, za pilule - u gramima po 1 tableti, u otopinama za injekcije - u gramima po 1 ml).
Mikrobiološka čistoća (metoda određivanja mikroorganizama, njihove dopuštene granice).
Pakiranje (vrsta primarne ambalaže, broj jedinica proizvoda u primarnoj ambalaži, sekundarnoj ambalaži, broj primarnih ambalaža u njoj, načini pečaćenja; dane su reference na regulatorne dokumente koji određuju vrste i kakvoću skupne i transportne ambalaže itd.).
Označavanje (dano u skladu sa zahtjevima za Grafički dizajn lijekovi).
Rok trajanja (razdoblje tijekom kojeg se lijek može koristiti).
Farmakološko djelovanje (farmakološka skupina kojoj lijek pripada).
Naziv lijeka na ruskom.
Uvodni dio.
Glavni dio.
13.1.4. Struktura i sadržaj standarda za ljekovite biljne materijale (angro)
GOST za ljekovite biljne materijale (angro) ima sljedeću strukturu i sadržaj:
Naziv ljekovitog biljnog materijala na ruskom i latinskom jeziku.
Uvodni dio.
Uključuje naziv i opseg ljekovitog biljnog materijala, biljku i porodicu (na ruskom i latinskom).
Vanjski znakovi ( Kratki opis morfološke značajke cijelih i usitnjenih sirovina).
Mikroskopija (opis dijagnostičkih svojstava sirovina);
Kvalitativne reakcije (metode kvalitativnih kemijskih reakcija ili kromatografskih uzoraka).
Kvantitativni pokazatelji (postotni udio djelatnih tvari, biološka aktivnost, vlažnost, ukupni i netopivi pepeo u 10% otopini klorovodične kiseline, dopuštene nečistoće i usitnjenost).
Kvantifikacija (metode određivanja sadržaja djelatnih tvari).
Mikrobiološka čistoća (metoda određivanja mikroorganizama, njihove dopuštene granice).
Pakiranje (vrsta primarne ambalaže, broj jedinica proizvoda u primarnoj ambalaži, sekundarnoj ambalaži, broj primarnih ambalaža u njoj, načini pečaćenja; dane su reference na regulatorne dokumente koji određuju vrste i kakvoću skupne i transportne ambalaže itd.).
Označavanje (osigurano u skladu sa zahtjevima za grafički dizajn lijekova).
Skladištenje (navedeni su uvjeti skladištenja proizvoda, ako je potrebno, zahtjevi za zaštitu proizvoda od utjecaja klimatskih čimbenika).
Rok trajanja (razdoblje u kojem se ljekovite biljne sirovine mogu koristiti).
Farmakološko djelovanje (farmakološka skupina u koju se svrstavaju ljekovite biljne sirovine).
Glavni dio.
Za lijekove, slično kao i za medicinske proizvode, postoje različite vrste potvrda kvalitete proizvoda prema zahtjevima državnog standarda, što uključuje ocjena sukladnosti, koje uključuje: ocjenjivanje sukladnosti, registracija, akreditacija, kontrola i nadzor itd.
U ocjeni sukladnosti sudjeluju tri skupine osoba koje predstavljaju dvije zainteresirane strane (npr. dobavljača i kupca) i jednu neovisnu osobu - osobu ili tijelo koje djeluje kao arbitar.
Glavne radnje u ocjeni sukladnosti su potvrđivanje sukladnosti proizvoda ili drugih predmeta, proizvodnih procesa, rada, skladištenja, prijevoza, prodaje i zbrinjavanja, izvođenja radova ili pružanja usluga sa zahtjevima tehničkih propisa, odredbama normi ili uvjetima ugovora. .
Potvrda sukladnosti može biti dobrovoljna ili obvezna. Obvezna potvrda provodi se u obliku prihvaćanja izjave o sukladnosti i obvezne certifikacije.
13.3. Registracija lijekova
Sukladno čl. I9 Saveznog zakona br. 86-FZ od 22.06.98 "O lijekovima" u Rusiji, samo oni lijekovi koji su odobreni za uporabu i registrirani u skladu s pravilima br. 10 / 29-14 od 12.1./ 98, koji definira jedinstvene zahtjeve, može se koristiti za dokumentaciju za domaće i strane lijekove, postupak i uvjete njihove registracije. Sukladno ovom zakonu i pravilima registracije, upisu podliježu:
novi lijekovi;
nove kombinacije prethodno registriranih lijekova;
prethodno registrirani lijekovi koji se proizvode u drugim oblicima, s novim doziranjem ili drugim sastavom pomoćnih tvari;
generički lijekovi.
Istodobno, za potonje je predviđen postupak ubrzane registracije.
Državnu registraciju lijeka provodi Savezno tijelo za kontrolu kvalitete lijekova u roku koji ne prelazi 6 mjeseci (isključujući razdoblje kliničkih ispitivanja) od datuma podnošenja zahtjeva za državnu registraciju.
Podnositelj zahtjeva može biti organizacija koja razvija lijek ili neka druga entitet u ime razvojnog programera.
Registrirani lijekovi upisuju se u Državni registar lijekova.
Valjanost potvrde o registraciji je 5 godina uz naknadnu moguću preregistraciju.
Postupak registracije lijekova u Ruskoj Federaciji je vrlo skup i prilično dugotrajan proces, posebno kada se registriraju uvezeni originalni lijekovi, a uključuje:
Preliminarno ispitivanje registracijskog dosjea.
Priprema registracijskog dosjea:
prijevod niza službenih, instruktivnih i normativno-tehničkih dokumenata na ruski jezik;
priprema dokumentacije za kontrolu kvalitete i stabilnosti lijeka (kontrola finalnog proizvoda) u skladu s Ruskom farmakopejom i nacionalnim standardima;
umnožavanje materijala za dosje u potrebnim količinama.
Podnošenje dosjea na Savezna služba o nadzoru u području zdravstva i socijalnog razvoja.
Ispitivanje (uz sudjelovanje specijaliziranih komisija) materijala u smislu sigurnosti i učinkovitosti predstavljenog lijeka, mogućnost njegove registracije u Rusiji.
6. Ishođenje dozvola za provedbu.
13.4. Licenciranje djelatnosti proizvodnje i prometa medicinskih i farmaceutskih proizvoda
Sukladno čl. 15 Saveznog zakona br. 86-FZ od 22. lipnja 1998. "O lijekovima" i savezni zakon 128 od 08.08.01. „O licenciranju određenih vrsta djelatnosti” sve farmaceutske tvrtke koje se bave proizvodnjom ili prometom lijekova na domaćem tržištu, bez obzira na oblik vlasništva, podliježu licenciranju.
Izdavanje savezne dozvole za trgovina na veliko a proizvodnim licencama za J1C upravljaju komisije za licenciranje na saveznoj razini. Međutim, zbog velikog broja subjekata farmaceutskog tržišta u našoj zemlji, Ministarstvo zdravstva Ruske Federacije također je iskoristilo svoja zakonodavna prava u dopisima od 16. srpnja 2002. br. 2510/7125-02-32 „O prijenosu ovlasti za licenciranje farmaceutskih djelatnosti” i br. 02-32 „O prijenosu dijela ovlasti za licenciranje djelatnosti povezanih s prometom opojnih droga i psihotropnih droga” prenijelo izdavanje teritorijalnih dozvola za trgovinu na veliko i malo na lokalno (teritorijalno) licenciranje provizije.
Tvrtke koje dobiju dozvolu za proizvodnju lijekova podliježu najvišim zahtjevima.
Od 1994. Ministarstvo zdravstva Rusije izdalo je više od 500 dozvola za proizvodnju lijekova poduzećima i ustanovama različitih organizacijskih i pravnih oblika i odjelske pripadnosti (za usporedbu, do 1992. samo oko 200 tvornica i tvornica obavljalo je takve aktivnosti u cijelom SSSR-u)
Dokumenti koji se podnose komisiji za licenciranje uključuju:
podaci o proizvođaču; popis lijekova koji će se proizvoditi; razne tehnološke informacije.
Pri donošenju odluke o izdavanju (ili odbijanju izdavanja) dozvole posebna se pozornost posvećuje usklađenosti tehničke razine proizvodnje sa suvremenom, a za nova proizvodna mjesta obvezno je usklađenost s industrijskim standardom OST 42- 510-98 “Pravila za organizaciju proizvodnje i kontrolu kvalitete lijekova (GMP)”.
Izdana dozvola za proizvodnju lijekova vrijedi u cijeloj Rusiji. Njegov rok valjanosti određuje komisija za licenciranje, ali ne može biti duži od 5 godina. Troškove povjerenstva za licenciranje za razmatranje i izdavanje licencije, kao i za ispitivanje s tim u vezi, plaća tvrtka koja je podnijela zahtjev za izdavanje licencije.
Licenciranje farmaceutske djelatnosti u području trgovine na veliko može se provoditi u dvije inačice: s izdavanjem teritorijalnih i federalnih dozvola. Prvi od njih daje pravo obavljanja trgovine na veliko samo na području koje je izdalo licencu.
Stroži zahtjevi nameću se prilikom izdavanja savezne dozvole koja dopušta trgovinu na veliko (kao i srodne aktivnosti, poput nabave, skladištenja lijekova) u cijeloj Rusiji. Savezna licenca izdaje se samo tvrtkama koje su dobile teritorijalnu licencu za ovu vrstu farmaceutske djelatnosti i za njih su radile najmanje 6 mjeseci.
Saveznu dozvolu izdaje Komisija za licenciranje Ministarstva zdravstva i socijalnog razvoja Ruske Federacije. Među dokumentima potrebnima za dobivanje navedenog nalazi se preslik ugovora o kontroli kvalitete lijekova s ovlaštenim kontrolnim i analitičkim tijelima; potvrdu o sudjelovanju u provedbi teritorijalnih medicinskih programa za opskrbu lijekovima za teritorije i regije; karakteristike djelatnosti tvrtke izdane od strane teritorijalne komisije za licenciranje; pokazatelji obima obavljenih aktivnosti. Tako komisija za licenciranje Ministarstva zdravstva dobiva priliku uvjeriti se da tvrtka ima dobru reputaciju na svom teritoriju i, zbog prirode svoje djelatnosti, objektivno treba dobiti saveznu licencu.
Licenciranje farmaceutske djelatnosti ljekarni je način državnog nadzora nad poštivanjem zahtjeva zakonodavstva u području farmaceutske djelatnosti u vezi s prometom lijekova. Djelatnost ljekarničke ustanove bilo kojeg oblika vlasništva zabranjena je bez državne dozvole. Licenciranje djelatnosti ljekarni provodi se u strogom skladu s važećim zakonodavstvom, kao i uputom Ministarstva zdravstva Ruske Federacije od 14.12.92. "O postupku licenciranja farmaceutske djelatnosti ljekarni i ljekarni u Ruskoj Federaciji".
Za dobivanje licence ljekarnička ustanova podnosi zahtjev povjerenstvu za licenciranje koje djeluje pri tijelima državne uprave, gradskim i okružnim jedinicama lokalne samouprave. Dakle, izdavanje licenci u Moskvi provodi se u Moskovskoj komori za licenciranje. Za dobivanje državne licence, ljekarnička ustanova komisiji za licenciranje podnosi sljedeće dokumente:
Izjava.
Kopija potvrde o državnoj registraciji ustanove (poduzeća), ovjerena od strane javnog bilježnika.
Kopija Statuta ili Pravilnika ovlaštene ustanove, odobrena na propisani način (ovjerena kod javnog bilježnika).
Primjerak narudžbe ili ugovora za iznajmljivanje sobe, oprema (ovjerena kod javnog bilježnika).
Popis vrsta farmaceutske djelatnosti, usluga prijavljenih za licenciranje.
Zaključak državnog sanitarnog nadzora.
Zaključak državnog požarnog nadzora.
Potvrde o akreditaciji ljekarničke ustanove i djelatnika.
Presliku prethodno izdane licence (za ustanovu koja je prethodno prošla licenciranje).
Presliku naloga za plaćanje jednokratne naknade za izdavanje dozvole.
Postupak izdavanja dozvola utvrđuje komisija i predviđa:
1) proučavanje dokumenata koje je dostavila ljekarna;
provođenje očevida na licu mjesta;
izdavanje licence.
Ako dokumentacija koju dostavi ljekarna ne ispunjava uvjete, vraća se podnositelju zahtjeva. Novi rok za razmatranje računa se od trenutka ponovnog podnošenja dokumenata.
Licenciranju podliježe svaka vrsta farmaceutske djelatnosti koju obavlja tvrtka koja podnosi zahtjev za licencu, a to su:
proizvodnja svih vrsta ljekovitih oblika prema receptima liječnika i zahtjevima zdravstvenih ustanova;
proizvodnja svih vrsta ljekovitih oblika prema često ponavljanim recepturama liječnika u malim serijama;
nadzor nad tehnologijom proizvodnje, skladištenja, kvalitete gotovih lijekova i lijekova proizvedenih u ljekarni, ljekovitog biljnog materijala i pripravaka od njega;
prijam, skladištenje, organiziranje, dostava, izdavanje lijekova i medicinskih proizvoda ljekarnama i zdravstvenim ustanovama;
prodaja stanovništvu i medicinskim ustanovama lijekova (proizvedenih u ljekarnama i gotovih) i medicinskih proizvoda odobrenih za uporabu u Ruskoj Federaciji.
Ljekarnička ustanova i pojedinci koji obavljaju pojedinačnu ili zajedničku djelatnost u sustavu opskrbe lijekovima prije dobivanja licence moraju proći akreditaciju koja se sastoji u utvrđivanju usklađenosti uvjeta i mjesta obavljanja djelatnosti s utvrđenim zahtjevima za ljekarne.
13.5. Certificiranje lijekova
Sustav certificiranja lijekova djeluje u okviru sustava obveznog certificiranja koji je uspostavio Državni standard Ruske Federacije, a trenutno ga vodi Savezna agencija za tehničku regulaciju i mjeriteljstvo.
Pravna osnova sustava certificiranja medicinskih i farmaceutskih proizvoda uključuje sljedeće pravni akti i narudžbe:
1. Osnove zakonodavstva Ruske Federacije o zaštiti zdravlja građana.
Uredba Vlade Ruske Federacije "O licenciranju određene vrste djelatnost” (od 24. 12. 94 br. 1418).
Pravilnik o Ministarstvu zdravstva Ruske Federacije (odobren Uredbom Vlade Ruske Federacije od 03.06.97 br. 659).
Dokumenti koje je odobrilo Ministarstvo zdravstva Ruske Federacije:
Pravila za provođenje certifikacije u Ruskoj Federaciji.
Izmjena br. 1 "Pravila za certifikaciju u Ruskoj Federaciji".
Postupak provođenja certifikacije u Ruskoj Federaciji.
Promjena br. 1 "Postupak certifikacije u Ruskoj Federaciji".
Pravila za uporabu znaka sukladnosti za obveznu certifikaciju proizvoda i sl.
GOST R 40.001-95. Pravila za certifikaciju sustava kvalitete u Ruskoj Federaciji.
GOST R 51000.1-95. Državni sustav standardizacija Ruske Federacije. Sustav akreditacije certifikacijskih tijela i ispitnih i mjernih laboratorija. Opći zahtjevi.
GOST R ISO/IEC 65-2000. Opći zahtjevi za certificiranje proizvoda itd.
Obvezna i dobrovoljna certifikacija provodi se prema gore opisanim shemama (vidi Poglavlje 11, Tablica 11.4) i predstavlja zadani skup radnji službeno prihvaćenih kao dokaz o sukladnosti lijekova sa zahtjevima tehničkog propisa i norme. Ovisno o zadatku certificiranja, odabire se shema i prema njoj se provodi provjera.
Rok valjanosti potvrde o sukladnosti za lijek odgovara datumu isteka valjanosti. U popratnoj dokumentaciji koja se prilaže uz certificirane proizvode sastavlja se zapisnik o ovjeri u kojem se navode: broj potvrde, rok valjanosti, tijelo koje ju je izdalo.
Postupak certificiranja lijekova je sljedeći: 1. Podnositelj zahtjeva podnosi zahtjev certifikacijskom tijelu. Uz prijavu se prilažu sljedeći dokumenti:
potvrda o registraciji Ministarstva zdravstva Rusije s dopuštenjem za korištenje J1C u medicinskoj praksi;
licenca za pravo proizvodnje (prodaje) J1C;
radnja uzimanja prosječnog uzorka (uzimanje prosječnog uzorka provodi se u skladu sa zahtjevima članka "Uzorkovanje (uzorkovanje) lijekova" Državne farmakopeje);
protokol analize proizvođača (za domaće J1C) ili certifikat analize tvrtke i njegov prijevod (za inozemne lijekove) s rezultatima provjere kvalitete lijeka za usklađenost sa zahtjevima ND nakon puštanja u promet.
Podnositelj zahtjeva može biti pravna osoba bilo kojeg oblika vlasništva (ili pojedinac) koja je dobila, u skladu s utvrđenim postupkom, dozvolu za proizvodnju, prodaju ili uvoz lijekova na teritoriju Ruske Federacije.
Trenutno u cijeloj Ruskoj Federaciji postoje potvrde o sukladnosti koje izdaje:
Centar za certificiranje medicinskih proizvoda Ministarstva zdravstva Rusije;
Centar za certificiranje i kontrolu kvalitete medicinskih proizvoda u Moskvi;
Državna zdravstvena ustanova "Sjeverozapadni centar za kontrolu kvalitete i certificiranje lijekova", Sankt Peterburg. Uzorak popunjavanja potvrde o sukladnosti za ogledni lijek do 6. travnja 2004. prikazan je na sl. 13.2.
13.6. Ekološki aspekti prodaje lijekova
Ekologija- je znanost o međusobnom odnosu biljnih i životinjskih organizama i njihovih zajednica i okoliš. Pojam je predložio Haeckel 1886. godine. U današnje vrijeme ekologija je dobila posebno značenje kao znanstvena osnova za racionalno korištenje prirodnih resursa i zaštitu živih organizama.
Od 1970-ih godina razvija se humana ekologija, odnosno socijalna ekologija, koja proučava obrasce interakcije društva i okoliša, kao i praktične probleme njegove zaštite. Ovo je od interesa:
1. Studija antropogenog utjecaja vanjskog okoliša na proizvod:
kontaminacija sirovina i materijala (osnovna faza);
zagađenje tijekom tehnološka proizvodnja(tehnološka faza);
onečišćenje tijekom transporta i skladištenja (faza rukovanja);
Sksgsna gotnkkavpk GOST R. MINISTARSTVO ZDRAVLJA RUSKE FEDERACIJE
DEPLGGLMSHT VESSEL(1""1"QC.>"FYa"MVN<К.Ш, Г.КЮНАСИОСГИ ЛЕКАРСТВЕННЫХ (РЬДСГ» II МЕДИМШСКОЙ ТЕХНИКИ
"m -Da -cast g os puše tvesh yue "naš 1 certifikat minsh gersgod zd?abs;phgsh;tsh
RUSKA FEDERACIJA"
Riža. 13.2. Uzorak popunjavanja certifikata za lijek.
POTVRDA O SUKLADNOSTI
" 16 "" iWII.
Fnig Yaymk JAO - SIL yutgtSHINP YATIA"
"K" shmyay lpyauien? yAfltroscpai:j. h> jaekgrsgyeinm znači, „
"-N^YASHSHSH
grkk goyaiosgi 19.W0S
j tilemkn W JU, N .itf pinuangle
".O ^ shtstvokg tloyliiyay SHI" MATNCHLOPG. 1 DSMSUMENTL
Itf-" IWS .....
C^JWjf.j^gaf"iJ" tfm m inis* poslanik. Tsshmyuiya ruski
<":::Щ"|)IR;1GKijffin TtaiXiiuB^BHH
j^ftirt- tutft/rtorfsm:*YY fv" 17 GJ _
Cpu*jarteTMW«pt»|ai™iir,TO ^..-"f " Zkamga 2V£Yah.

Kv tUkCKi K j!
kontaminacija tijekom uporabe (faza rada).
2. Studija utjecaja proizvoda na ekosustav i čovjeka
onečišćenje industrijskim proizvodima;
kontaminacija ambalaže;
utjecaj samog proizvoda.
Pod pojmom onečišćenja podrazumijeva se unošenje u bilo koji okoliš (atmosfera, voda, tlo, sirovine i sl.) novih, nepovoljnih, nepovoljnih agensa ili višak tih agensa u okolišu od prirodnog višegodišnjeg prosjeka.
Onečišćenje se događa kemijski(plinoviti, čvrsti, tekući i drugi agensi); fizički(toplinski, elektromagnetski, radijacijski itd.); mehanički(kontaminacija elementima pakiranja); biološki(onečišćenje mikroorganizmima, insektima itd.).
Godine 1989. na farmaceutskom fakultetu VMA nazvan. I. M. Sechenov, osnovan je Znanstveno-metodološki centar za analizu mikroelemenata lijekova i biljnih sirovina. Oko 80% vrsta ljekovitog bilja je istraženo na sadržaj teških metala.
zamke najsuvremenijim metodama: atomska apsorpcijska spektroskopija, atomska emisijska spektroskopija, X-fluorescentna spektroskopija i dr.
U lipnju 1990. održan je Prvi međunarodni znanstveni simpozij "Aspekti zaštite okoliša u farmaciji", na kojem je donesena odluka o stvaranju državnog programa "Ekološka sigurnost lijekova", uključujući stvaranje ekološki prihvatljivih tehnologija, složenu preradu sirovina. materijala, razvoj rada na biotehnologiji, identifikaciju i regulaciju spojeva antropogenog podrijetla u prirodnim ljekovitim sirovinama, unapređenje i unificiranje metoda i sustava kontrole, stvaranje baza podataka i regionalnih informacijskih sustava. Od 2000. godine na farmaceutskim fakultetima uveden je novi kolegij "Ekologija lijekova".
Pitanja za samokontrolu (modul 4)
Koliko je važna kvaliteta medicinskih i farmaceutskih proizvoda?
Koje vrste pokazatelja kvalitete poznajete?
Koji dokumenti reguliraju kvalitetu medicinskih i farmaceutskih proizvoda?
Koje je značenje standardizacije kao faktora koji utječe na formiranje uporabne vrijednosti farmaceutskih proizvoda?
Koji su ciljevi i ciljevi normizacije?
Koji se standardi primjenjuju u ljekarničkoj mreži za rad s farmaceutskim proizvodima, s izuzetkom lijekova? Dajte im opis.
Koji se standardi koriste za rad s lijekovima? Dajte im opis.
Zašto certifikacija utječe na uporabnu vrijednost robe?
Što znači certifikacija i zašto je potrebna u farmaceutskoj praksi?
Koji dokumenti reguliraju certificiranje lijekova?
Koja je svrha licenciranja medicinske i farmaceutske djelatnosti?
Koje su sličnosti i razlike između GOST-a za medicinske proizvode i FS-a za lijekove?
OSNOVE ROBNE ANALIZE
STANDARDIZACIJA(eng. standart norma, uzorak, mjera) - proces uspostavljanja i primjene standarda, tj. skup normativnih i tehničkih dokumenata koji reguliraju skup normi, pravila, zahtjeva za predmet normizacije, odobrenih od strane nadležnog tijela. S. se provodi u odnosu na materijalne objekte (industrijski i poljoprivredni proizvodi, standardi, uzorci tvari) i nematerijalne (norme, pravila i zahtjevi za razne namjene). Predmet S. su i različiti oblici usluga, metode i sredstva za osiguranje jedinstva i točnosti mjerenja, terminologija, standardni oblici dokumenata, simboli, zaštita okoliša i racionalno gospodarenje prirodom itd. Posebno područje djelovanja S. je medicina. , u roju lijekovi, drugi proizvodi med služe kao objekti S.-a. odredište, zaštita na radu (vidi dolje).
Tipičan primjer iz regije S. može poslužiti tzv. standardni uzorci, odnosno tvari koje imaju prilično točno poznate i službeno potvrđene vrijednosti svojstava (parametara) specifičnih za određenu tvar. Po svojoj namjeni spadaju u razred mjeriteljskih sredstava (vidi Mjeriteljstvo). Izrađuju se prema posebnoj tehnologiji, a vrijednosti svojstava (parametara) utvrđuju se na temelju rezultata istraživanja provedenih prema zadanom programu.
Referentni materijali imaju široku primjenu u vađenju i preradi mineralnih sirovina, u kontroli sirovina i materijala koji se isporučuju u okviru međunarodne gospodarske suradnje, u zdravstvu (za objedinjavanje kliničkih i biokemijskih analiza), u području zaštite okoliša. zaštita (nadzor i kontrola onečišćenja okoliša) itd. d.
U SSSR-u standardizacija je jedan od elemenata državne tehničke politike, usko povezana sa sustavom planiranja i upravljanja nacionalnim gospodarstvom. Glavni zadatak S. u ovom slučaju je uspostavljanje jedinstvenih zahtjeva za tehničku razinu i kvalitetu proizvoda, sirovina, materijala, komponenti, kao i standardizacija zahtjeva i metoda za projektiranje i proizvodnju proizvoda za jednu namjenu. ili drugi. Korištenje standarda na nacionalnoj razini pomaže u poboljšanju kvalitete proizvoda, osigurava povećanje razine unifikacije i zamjenjivosti, stvara najbolje mogućnosti za automatizaciju određenih proizvodnih procesa i poboljšanje radnih uvjeta.
Državni sustav standarda SSSR-a objedinjuje rad na S. na svim razinama upravljanja nacionalnim gospodarstvom. To je skup pravila i propisa koji objedinjuje ciljeve i ciljeve S.; organizacija i tehnika provođenja S.; postupak za razvoj, provedbu i cirkulaciju regulatornih dokumenata, kao i izmjene u njima; postupak državnog nadzora i resorne kontrole nad njihovom provedbom i poštivanjem; S. objekti, kategorije i vrste standarda i dr. Planiranje svih djelatnosti na području S. sastavni je dio sustava državnog uređenja.
Prvi dokument u povijesti sovjetske vlasti na području mjerenja bio je dekret Vijeća narodnih komesara RSFSR-a (1918.) "O uvođenju međunarodnog metričkog sustava mjera i utega". Prvi svesavezni standard uveden je u SSSR-u 1926.: OST-1 „Pšenica. Selekcijske sorte žitarica. Nomenklatura". Sljedećih godina razvijeni su i odobreni brojni standardi koji su pokrivali gotovo sve grane industrije i poljoprivrede u Sovjetskom Savezu. Godine 1978. već postoje sv. 20 tisuća
Karakteristična značajka S. u našoj zemlji je prijelaz s pojedinačnih S. na razvoj i implementaciju međusektorskih sustava standarda od nacionalnog značaja. Tu spadaju: Državni normizacijski sustav (SSS), Državni mjerni sustav (GSP), Jedinstveni sustav projektne dokumentacije (ESKD), Jedinstveni sustav tehnološke dokumentacije (ESTD), Jedinstveni sustav tehnološke pripreme proizvodnje (ESTPP) , Jedinstveni sustav standarda zaštite na radu (ESSBT), sustav standarda zaštite okoliša i dr. Također se izrađuju programi cjelovite zaštite okoliša za najvažnije vrste proizvoda. Oni daju jedinstvene zahtjeve za tehničku razinu i kakvoću proizvoda, sastavnih dijelova, sirovina, materijala i opreme, za sredstva kontrole, mjerenja i ispitivanja proizvoda itd.
Od 1954. Državni odbor SSSR-a za standarde (Gosstandart) provodi opće upravljanje S. na razini cijele zemlje, au području lijekova, cjepiva i seruma - M3 SSSR-a. Sustav tijela i službi Državnog standarda SSSR-a uključuje republičke uprave, centre za S. i mjeriteljstvo, istraživačke institute i laboratorije za državni nadzor poštivanja standarda. St. 600 glava, osnovne organizacije različitih grana nacionalnog gospodarstva SSSR-a obavljaju određene vrste poslova vezanih uz standardizaciju.
Uz Državni standard SSSR-a, M3 SSSR-a također ima pravo standardizacije u području medicine i zdravstvene zaštite. Odjel za uvođenje novih lijekova i medicinske opreme M3 SSSR-a provodi C. u vezi s lijekovima, medicinskom opremom, ljekarničkom opremom, medicinsko-biološkim i imunobiološkim pripravcima, kao i niz drugih mjera usmjerenih na očuvanje zdravlja ljudi.
Sami standardi, ovisno o redoslijedu odobrenja, kao i opsegu primjene, imaju nekoliko kategorija: državni standardi (GOST), industrijski (OST), republički (PCT), standardi poduzeća (udruga) - STP.
Državne standarde (GOST-ove) odobrava Državni odbor za standarde SSSR-a (Gosstandart), s iznimkom određenih vrsta standarda koje je odobrilo Vijeće ministara SSSR-a, Državni odbor za izgradnju SSSR-a (Gosstroy) i M3 SSSR-a.
GOST-ovi su obvezni za sva ministarstva, državne komitete, odjele SSSR-a, za sve državne, zadružne i druge javne organizacije.
Industrijske standarde (OST) odobravaju svesavezna i savezno-republička ministarstva, državni odbori i odjeli SSSR-a. Oni su obvezni za sva poduzeća, organizacije i institucije odjela koji su odobrili odgovarajući standard. OST za proizvode odobravaju ministarstva ili odjeli koji su glavni u dizajnu ili proizvodnji ove vrste proizvoda, a obvezni su za druga ministarstva (odjele), poduzeća, organizacije i institucije povezane s proizvodnjom, razvojem, prijevozom, skladištenje, rad proizvoda odgovarajućeg tipa.
Republičke standarde (RST) odobravaju republički savjeti ministara saveznih republika (ili, po njihovom nalogu, Državni komiteti za planiranje ili državne građevinske službe saveznih republika). PCT su obvezni za sva poduzeća, organizacije, ustanove koje se nalaze na teritoriju savezne republike, bez obzira na podređenost odjela.
Norme poduzeća ili udruženja (STP) obavezne su samo za poduzeće (udrugu), organizaciju i ustanovu koja je odobrila ovu vrstu norme.
Na temelju relevantnih standarda razvijaju se tehničke specifikacije (TS), odnosno regulatorni tehnički dokument (NTD) koji utvrđuje skup zahtjeva za određenu vrstu proizvoda.
U procesu C. norme razvijaju, odobravaju i mijenjaju posebna državna tijela na način propisan Sustavom državne normizacije. Za svaku normu predviđeni su rokovi stupanja na snagu, a područje primjene određeno je kategorijom norme (tj. nacionalna, sektorska, republička itd.).
Karakteristična značajka S. je njegova tehnička i pravna kompetencija. Ovo je tipično za S. u odnosu na proizvode, tehnološke procese, zaštitu okoliša, sigurnost na radu itd. Izvršenje i kontrola usklađenosti sa standardima osigurana je relevantnim normama važećeg zakona, koji predviđa zakonsku odgovornost za kršenje standard.
U području zdravstvene zaštite postoji cijeli sustav zakonodavnih akata (vidi Sanitarno zakonodavstvo), koji osigurava usklađenost sa standardima usmjerenim na očuvanje zdravlja sovjetske osobe (vidi Zdravlje na radu, Higijenski standardi, Zaštita okoliša, Zaštita rada i drugi slični artikli).
Karakteristična značajka sadašnje faze razvoja metrike u SSSR-u je složenost metrike. To se očituje u činjenici da kada određeni standardi stupe na snagu, pokazatelji međusobno povezanih standarda i vrijeme njihovog stupanja na snagu su predviđeno. Složenost S. osigurava se razvojem S. programa koji kombiniraju proizvode, poluproizvode i materijale, tehnička sredstva, organizaciju proizvodnje i tako dalje. Složenost S. omogućuje učinkovitije korištenje mogućnosti suvremene proizvodnje, ostvariti međusektorsku koordinaciju i zadovoljiti zahtjeve zainteresiranih strana.
Standardizacija u okviru CMEA-a u skladu je sa zadaćama Sveobuhvatnog programa za daljnje produbljivanje i unaprjeđenje suradnje i razvoja socijalističke gospodarske integracije zemalja članica Vijeća za gospodarsku uzajamnu pomoć (CMEA). S. u SEV-u bave se Stalna komisija za S., sektorske stalne komisije, Institut SEV-a za S. i S. odjel tajništva SEV-a. Glavna područja rada su stvaranje sustava normativnih i tehničkih dokumenata (sustav normativne i tehničke dokumentacije CMEA za S.; automatizirani informacijski i upravljački sustav S. i mjeriteljstva CMEA; jedinstveni sustav dizajna dokumentacija CMEA; jedinstveni sustav tolerancija i iskrcaja CMEA), kao i složeni standardi za proizvode koji su predmet trgovine između zemalja članica CMEA. Norme i zahtjevi standarda CMEA odgovaraju međunarodnim standardima. Do 1. siječnja 1975. usvojeno je 4900 preporuka CMEA o S. i 120 standarda CMEA. 28. zasjedanje CMEA (21. lipnja 1974.) odobrilo je "Pravilnik o standardu CMEA (CMEA ST)" i odobrilo Konvenciju o izravnoj (neposrednoj) primjeni standarda CMEA. Konvenciju o primjeni ST CMEA-a ratificirao je Prezidij Vrhovnog sovjeta SSSR-a dekretom od 17. rujna 1974. Razvoj i primjena standarda CMEA-a imaju odlučujući utjecaj na intenziviranje procesa socijalističke ekonomske integracije, unapređenje međunarodne socijalističke podjele rada, povećanje razine proizvodnje i kvalitete proizvoda te jačanje konkurentnosti socijalističkih proizvoda.zemalja na svjetskim tržištima i daju značajan gospodarski učinak. Korištenje standarda CMEA u nacionalnim gospodarstvima zemalja članica CMEA dovodi do daljnje konvergencije nacionalnih računovodstvenih sustava.
Međunarodna normizacija povezana je s razvojem multilateralne znanstvene, tehničke i gospodarske suradnje. Uz nacionalne organizacije, pitanjima mjerenja, mjeriteljstva i poboljšanja kakvoće proizvoda bavi se više od 300 međunarodnih i regionalnih organizacija (1975). Na području S. djeluju najveće međunarodne organizacije: Ekonomska komisija Ujedinjenih naroda za Europu (UNECE), Međunarodna organizacija za normizaciju (ISO) i Međunarodna elektrotehnička komisija (IEC).
Međunarodni standardi i preporuke koje su razvile ove organizacije uspostavljaju pokazatelje koji zadovoljavaju suvremene znanstvene i tehničke zahtjeve za kvalitetu, pouzdanost, sigurnost i druga važna svojstva i karakteristike različitih vrsta proizvoda koji su predmet međunarodne trgovine, a također definiraju jedinstvene metode i sredstva ispitivanja i certificiranja materijala i robe. Primjena međunarodnih standarda doprinosi širenju znanstvenih, tehničkih, gospodarskih i trgovinskih odnosa. Međunarodne norme naširoko se koriste u razvoju nacionalnih normi, što može značajno smanjiti vrijeme i troškove njihove izrade i postići veliki ekonomski učinak.
Standardizacija u medicini
Standardizacija u medicini je razvoj i uporaba jedinstvenih normi, pravila, zahtjeva u razvoju i primjeni medicinskih, imunoloških i drugih terapeutskih, preventivnih i dijagnostičkih sredstava, kao i medicinske opreme. C. doprinosi racionalizaciji ovih procesa, uzimajući u obzir zahtjeve i uz sudjelovanje svih zainteresiranih strana. C. provodi se uzimajući u obzir dostignuća znanosti, tehnologije, najbolje prakse medicinskih, sanitarno-epidemioloških, istraživačkih, farmaceutskih i drugih medicinskih ustanova, kao i poduzeća medicinske i druge industrije koja proizvode proizvode za medicinsku dijagnostiku i preventivu svrhe. Rezultati S. odražavaju se u normativnim i tehničkim dokumentima - standardima koji su obvezni za uporabu i nekim drugim dokumentima slične namjene (norme, metode njihove kontrole, upute, medicinski tehnički zahtjevi, pravila, regulatorni materijali, metodološke preporuke i upute) razvijene na propisani način i odobrene od strane nadležnih odjela M3 SSSR-a.
Specifikacije - regulatorni i tehnički dokumenti (NTD) koji uspostavljaju skup zahtjeva za određene vrste, marke, artikle proizvoda. Specifikacije su sastavni dio kompleksa tehničke dokumentacije za proizvode na koje se odnose. Specifikacije koje sadrže zahtjeve koji se odnose na osiguranje sigurnosti na radu i zaštite zdravlja radnika i zaposlenika podliježu dogovoru sa zdravstvenim vlastima na način koji utvrđuje Ministarstvo zdravstva SSSR-a.
Medicinski i tehnički zahtjevi (tehničke specifikacije) izrađuju se na temelju proučavanja i analize dostignuća domaće i strane tehnologije, napredne proizvodne tehnologije, rezultata istraživačkog rada, kao i na temelju zahtjeva naručitelja - M3 od SSSR.
Medicinsko-tehničke zahtjeve (tehničke specifikacije za proizvode medicinske opreme i druge medicinske proizvode) odobrava Ured za uvođenje novih lijekova i medicinske opreme M3 SSSR-a i tijelo kojem je podređena organizacija razvojnog programera.
S. se u medicini koristi u vezi s lijekovima (vidi Farmakopeja, Državni registar, Kontrola lijekova), ljekarničkom opremom (vidi Farmacija), medicinskim uređajima i medicinskom opremom, kao što su: alati, uređaji, aparati, sredstva za njegu bolesnika , med. opreme i dr. (vidi Medicinska oprema), med. biološki i imunobiološki pripravci (vidi Bakterijski standard, Kontrola bakterijskih pripravaka), hrana (vidi Prehrana), posebne vrste odjeće (vidi Posebna odjeća), osobna zaštitna oprema (vidi). Osim materijalnih objekata, S. pokriva u medicini cijeli sustav normi koji se propisuju u obliku pravila, preporuka (metodoloških) zahtjeva itd. higijenskih i organizacijskih mjera, kliničkih ispitivanja, laboratorijskih istraživanja. Ovo također uključuje regulatorne zahtjeve za radne uvjete propisane sanitarnim pravilima (vidi Zdravlje na radu, Zaštita na radu, Najveće dopuštene koncentracije, Sigurnosne mjere, Rad, Ergonomija) i radne standarde povezane sa zračenjem ili toksičnim opasnostima (vidi Radioaktivne tvari, Radijacijska higijena, Zračenje sigurnost, toksikologija), stanje zraka u kućanskim, sportskim i drugim prostorima, kakvoća vode, čistoća tla, veličina i kvaliteta životnog prostora (vidi Komunalna higijena), emisije iz industrijskih poduzeća (vidi Zaštita okoliša) i sve druge norme koje su bitne za zaštitu javnog zdravlja, kao i zahtjeve za poštivanje tih normi (vidi Higijenski standardi, Sanitarna inspekcija, Sanitarno zakonodavstvo, Sanitarno-epidemiološka stanica, Sanitarni nadzor). Posebno mjesto zauzima standardizacija mjernih metoda, mjerne opreme i mjernih jedinica koje se koriste (vidi Mjerne jedinice, Međunarodni sustav jedinica, Mjeriteljska zdravstvena služba, Mjeriteljstvo, Mjerni instrumenti za medicinske svrhe). Stranica se proteže i na med. dokumentaciju (vidi Medicinsku dokumentaciju) i med. nazivlje (vidi Medicinsko nazivlje).
Planiranje rada na standardizaciji u području medicine pripada uglavnom M3 SSSR-a. Sav rad na S. u sustavu M3 SSSR-a povjeren je Upravi za uvođenje novih lijekova i medicinske opreme M3 SSSR-a. Osim toga, relevantni stručnjaci iz glavnih uprava i uprava M3 SSSR-a sudjeluju u radu na S.: sanitarnoj i epidemiološkoj, farmaciji, medicinskoj i preventivnoj skrbi, medicinskoj i preventivnoj skrbi za djecu i majke, karantenskim infekcijama, za proizvodnju bakterijskih i virusnih pripravaka, Državni inspektorat za kontrolu kakvoće lijekova i medicinske opreme.
Priprema standardizacijske dokumente i standarde, obavlja standardizacijsku službu u M3 sustavu SSSR-a, glavnih (GOS) i baznih (BOS) organizacija za standardizaciju, istraživačkih instituta koji obavljaju zadatke standardizacije, te odjela za standardizaciju i mjeriteljstvo sanitarnih i epidemioloških stanica, voditelja i bazna organizacija mjeriteljske zdravstvene službe (vidi Mjeriteljska zdravstvena služba).
Bibliografija: Babayan E. A. i Utkin O. B. Osnovne odredbe za odobravanje lijekova u SSSR-u i stranim zemljama, M., 1982; Državni sustav standardizacije, M., 1975; Državna farmakopeja Saveza Sovjetskih Socijalističkih Republika, M., 1968; Stručno povjerenstvo WHO-a za specifikacije farmaceutskih proizvoda, Ser. tehn. izvješće br. 645, Ženeva, 1981.; Međunarodna farmakopeja, svezak 1-2, Ženeva, 1981.; Metodološki vodič za laboratorijsko ocjenjivanje kakvoće bakterijskih i virusnih pripravaka, ur. S. G. Džagurova i drugi, str. 5, M., 1972; All-Union klasifikator, Industrijski i poljoprivredni proizvodi, Više klasifikacijske skupine, M., 1977; Osnove zakonodavstva SSSR-a i saveznih republika o zdravstvenoj zaštiti, M., 1970; Sustav standarda zaštite na radu, M., 1978; Sklyarov A. M. i Serebryany L. A. Zahtjevi sustava standarda zaštite na radu i njihovo mjesto u regulatornoj i tehničkoj dokumentaciji, Gig. rada i prof. ilustr., br. 12, str. 1, 1979.; Standardi, sojevi i metode suzbijanja bakterijskih i virusnih pripravaka, ur. S. G. Džagurova i sur., M., 1979; Sumarokov A. A. Analiza znanstvenih i metodoloških osnova standardizacije cjepiva na modelu kolerogen-anatoksin, Zh. mikro, epid. i imuno., br. I, str. 32, 1975.; Sumarokov A.A., Salmin L.V. i Khlyabich G.N. Epidemiološka procjena sustava pokazatelja koji karakteriziraju kvalitetu pripravaka cjepiva, ibid., br. 7, str. 78; Utyamyshev R. I. i Grishin A. N. Izgledi za razvoj integriranog sustava upravljanja kvalitetom za medicinsku opremu u zdravstvenom sektoru, Standardi i kvaliteta, br. 1, str. 43, 1983.
E. A. Babayan, M. Ya. Kaabak, V. Ya. Maksimov; S. G. Dzagurov, A. A. Sumarokov (im.), Yu. F. Krylov, V. D. Kucherenko (farm.), L. A. Potanina, L. A. Serebryany (gig.).
Uvod
Lijekovi (PM) - tvari ili mješavine tvari prirodnog ili sintetskog podrijetla koje se koriste za liječenje, prevenciju i dijagnostiku bolesti. Često se kao lijekovi koriste otrovne i jake tvari (arsen, živa, opojne droge i psihotropne tvari) koje u slučaju predoziranja mogu dovesti do teških trovanja, pa čak i smrti. Među lijekovima postoje čak i oblici doziranja koji su potencijalno opasni po zdravlje, posebice injekcije, u kojima i bezopasne tvari postaju opasne (mehaničke inkluzije), s potpuno neriješenim problemima pirogenosti i sterilnosti. Ova specifičnost nameće stroge zahtjeve standardizaciji i metodama kontrole kvalitete lijekova koji bi trebali jamčiti njihovu sigurnost i farmakološko djelovanje. U tom smislu, kao i s utvrđenom tradicijom, standardizaciju i kontrolu kvalitete lijekova u svim zemljama obično provodi zasebna neovisna državna struktura.
Opća načela sustava standardizacije lijekova
Standardizacija lijekova- razvoj i primjena jedinstvenih zahtjeva i metoda za proučavanje oblika doziranja (standarda).
LS standard kvalitete- regulatorni dokument koji sadrži popis standardiziranih pokazatelja i metoda za kontrolu kvalitete lijekova, odobren od strane Ministarstva zdravstva Ruske Federacije (Ministarstvo zdravstva Rusije).
Sustav standardizacije treba postaviti takve zahtjeve za razvoj, klinička ispitivanja, proizvodnju i prodaju lijekova koji će osigurati njihovu maksimalnu sigurnost, potrebno farmakološko djelovanje i zajamčenu kvalitetu u svim fazama njihove uporabe.
Općenito, takvi se zahtjevi najpotpunije odražavaju u zahtjevima GLP (Good Laboratory Practice), GCP (Good Clinical Practice) i GMP (Good Manufacturing Practice), koji su posebni slučajevi međunarodnih normi ISO 9000 i reguliraju predklinička i klinička ispitivanja, proizvodnja i promet droga . Imajte na umu da USP XXIII također sadrži GMP zahtjeve za lijekove. Trenutačno su domaći GMP zahtjevi pripremljeni u Ukrajini.
Prijelaz na zahtjeve GLP-a, GCP-a i GMP-a zahtijeva prilično visoku kulturu proizvodnje i visoke materijalne troškove. U onim zemljama u kojima iz nekog razloga još nisu stvoreni uvjeti za potpuni prijelaz na ove zahtjeve, njihovi se glavni elementi koriste pri stvaranju sustava standardizacije lijekova.
Osnovni principi standardizacije lijekova:
1. Mogu se prodavati samo oni lijekovi koji su odobreni za medicinsku upotrebu i prodaju u određenoj zemlji.
standardizacija certifikacija lijekova
2. Prodavati se mogu samo oni lijekovi za koje postoji analitička normativno-tehnička dokumentacija (NTD) odobrena ili suglasna od nadležnog državnog tijela.
3. NTD treba osigurati objektivnu kontrolu kvalitete lijekova dobivenih ovom tehnologijom. U općem slučaju, specifična NTD može pružiti objektivnu kontrolu lijeka dobivenu samo određenom tehnologijom.
4. Razina proizvodnje treba osigurati mogućnost dobivanja lijekova s pokazateljima kvalitete propisanim NTD-om.
5. Sustav kontrole kvalitete prodanih lijekova treba omogućiti mogućnost otkrivanja nedostataka.
Stavak 3. znači da, općenito, jedan te isti NTD ne može kontrolirati lijekove dobivene različitim tehnologijama. Na primjer, u nekim tehnološkim shemama za dobivanje tvari paracetamola ne koriste se organska otapala, stoga se u NTD-u razvijenom za ovu tehnologiju ne kontroliraju. Ako se razvija nova tehnologija za proizvodnju paracetamola, koja koristi npr. benzen, onda je očito da se njegova kvaliteta ne može kontrolirati prema prethodnoj NTD. Potrebno je dodatno uvesti kontrolu rezidualnih količina benzena. Slična situacija je i kod kontrole tehnoloških nečistoća, koje se mogu bitno razlikovati za različite tehnologije. Dakle, sadašnji NTD, općenito, može kontrolirati samo tehnologiju na temelju koje je razvijen. Sve promjene u tehnologiji mogu zahtijevati prilagodbu zahtjeva NTD-a.
Nažalost, zahtjevi iz stavka 3. vrlo se često pogrešno shvaćaju i podcjenjuju. Tipična situacija: u Ukrajinu je uvezena uvezena tvar (paracetamol) čija je tehnologija proizvodnje bila nepoznata, kontrolirana je prema važećem NTD-u i na temelju toga donesen je zaključak o kvaliteti te tvari. Očito, to nije dovoljno. Budući da je tehnologija nepoznata, zaostala otapala, procesne nečistoće su nepoznate, što se možda neće kontrolirati gore navedenim NTD. Ako postoji potreba za uvozom ove tvari, potrebno je provesti dodatne (prije svega kromatografske) studije. Slična je situacija i s gotovim lijekovima.
Stavak 4. znači da ne može svaka farmaceutska tvrtka proizvoditi ovaj lijek. Na primjer, proizvodnja injekcija zahtijeva posebne zahtjeve za čistoću, opremu i osoblje. U suprotnom, u osnovi je nemoguće dobiti kvalitetan lijek.
Točka 5 karakterizira odnos između proizvođača i potrošača. Sustav kontrole kvalitete treba osigurati da proizvođači održavaju odgovarajuću razinu proizvodnje, poštuju zahtjeve znanstveno-tehničke dokumentacije i propisa, kao i mogućnost otkrivanja slučajnog braka i krivotvorina. Potonje je posebno važno za snažne i vitalne lijekove.






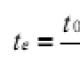



Samo će ljubavnici preživjeti
Značajke oglašavanja namijenjenog djeci
retuširanje starih fotografija u photoshopu retuširanje starih fotografija
Što je NPO: dešifriranje, definiranje ciljeva, vrste aktivnosti Ima li neprofitna organizacija pravo
Gleb Nikitin Prvi zamjenik