 Standardizarea este activitatea de stabilire a regulilor și caracteristicilor în scopul reutilizării lor voluntare, având ca scop realizarea ordinii în domeniile producției și circulației produselor și creșterea competitivității.
Standardizarea este activitatea de stabilire a regulilor și caracteristicilor în scopul reutilizării lor voluntare, având ca scop realizarea ordinii în domeniile producției și circulației produselor și creșterea competitivității.
 Standardizarea în domeniul circulației medicamentelor vizează asigurarea calității unui obiect standardizat, care cuprinde produse (materii prime și materiale, medicamente finite etc.), servicii, procese.
Standardizarea în domeniul circulației medicamentelor vizează asigurarea calității unui obiect standardizat, care cuprinde produse (materii prime și materiale, medicamente finite etc.), servicii, procese.
 Standardizarea în raport cu domeniul circulației medicamentelor este procesul de stabilire și aplicare a standardelor care conțin un set de norme, reguli, cerințe pentru obiectul standardizării, inclusiv toate medicamentele, inclusiv produsele homeopatice, parafarmaceutice, serviciile și procesele din domeniul circulaţia medicamentelor, garantând calitatea acestora.
Standardizarea în raport cu domeniul circulației medicamentelor este procesul de stabilire și aplicare a standardelor care conțin un set de norme, reguli, cerințe pentru obiectul standardizării, inclusiv toate medicamentele, inclusiv produsele homeopatice, parafarmaceutice, serviciile și procesele din domeniul circulaţia medicamentelor, garantând calitatea acestora.
 Scopul standardizării în domeniul circulației medicamentelor este protejarea consumatorilor și a statului asupra calității produselor farmaceutice, a proceselor de producere, promovare, depozitare, distrugere a acestora etc. Astfel, standardizarea vizează asigurarea farmacologică, de mediu, tehnologică. siguranța, utilizarea rațională a resurselor.
Scopul standardizării în domeniul circulației medicamentelor este protejarea consumatorilor și a statului asupra calității produselor farmaceutice, a proceselor de producere, promovare, depozitare, distrugere a acestora etc. Astfel, standardizarea vizează asigurarea farmacologică, de mediu, tehnologică. siguranța, utilizarea rațională a resurselor.
 Principii implementate în timpul standardizării: 1. Utilizarea voluntară a standardelor și asigurarea condițiilor pentru aplicarea uniformă a acestora. 2. Utilizarea unui standard internațional ca bază pentru elaborarea unui standard național, cu excepția cazurilor în care respectarea cerințelor standarde internaționale imposibil din cauza inconsecvenței cerințelor lor cu caracteristicile climatice și geografice ale Federației Ruse sau cu caracteristicile tehnice (tehnologice). În special, proiectul de articole de farmacopee generală pentru Farmacopeea de Stat a XII-a ia în considerare cerințele moderne ale farmacopeilor străine.
Principii implementate în timpul standardizării: 1. Utilizarea voluntară a standardelor și asigurarea condițiilor pentru aplicarea uniformă a acestora. 2. Utilizarea unui standard internațional ca bază pentru elaborarea unui standard național, cu excepția cazurilor în care respectarea cerințelor standarde internaționale imposibil din cauza inconsecvenței cerințelor lor cu caracteristicile climatice și geografice ale Federației Ruse sau cu caracteristicile tehnice (tehnologice). În special, proiectul de articole de farmacopee generală pentru Farmacopeea de Stat a XII-a ia în considerare cerințele moderne ale farmacopeilor străine.
 Principii implementate în cursul standardizării: 3. Inadmisibilitatea creării de obstacole în producerea și circulația produselor, efectuarea muncii și prestarea de servicii într-o măsură mai mare decât este minim necesar pentru atingerea obiectivelor standardizării. 4. Echilibrul de interese ale părților care dezvoltă, furnizează și consumă produse (servicii). Acest principiu înseamnă că participanții la munca de standardizare, pe baza capacităților producătorului de produs și furnizorului de servicii, pe de o parte, și de cerințele consumatorului, pe de altă parte, trebuie să găsească un consens, care este înțeles ca un acord. Cu alte cuvinte: lipsa obiecțiilor pe probleme semnificative din partea majorității părților interesate, dorința de a ține cont de opiniile tuturor părților și de a reuni punctele de vedere divergente. 5. Consecvența standardizării, care presupune considerarea obiectului standardizării ca parte a unui sistem mai complex.
Principii implementate în cursul standardizării: 3. Inadmisibilitatea creării de obstacole în producerea și circulația produselor, efectuarea muncii și prestarea de servicii într-o măsură mai mare decât este minim necesar pentru atingerea obiectivelor standardizării. 4. Echilibrul de interese ale părților care dezvoltă, furnizează și consumă produse (servicii). Acest principiu înseamnă că participanții la munca de standardizare, pe baza capacităților producătorului de produs și furnizorului de servicii, pe de o parte, și de cerințele consumatorului, pe de altă parte, trebuie să găsească un consens, care este înțeles ca un acord. Cu alte cuvinte: lipsa obiecțiilor pe probleme semnificative din partea majorității părților interesate, dorința de a ține cont de opiniile tuturor părților și de a reuni punctele de vedere divergente. 5. Consecvența standardizării, care presupune considerarea obiectului standardizării ca parte a unui sistem mai complex.
 Principii implementate în timpul standardizării: 6. Dinamismul și dezvoltarea avansată a standardului - document care stabilește caracteristicile produselor și proceselor pentru producerea, exploatarea, depozitarea, transportul, vânzarea și eliminarea acestuia, precum și regulile de implementare a acestora. Dinamismul este asigurat prin revizuirea periodică a documentelor de reglementare, modificări ale acestora sau anulare. Dezvoltarea avansată este facilitată de introducerea în standard a unor cerințe promițătoare pentru produse, procese, metode de control al acestora, indicatori de calitate etc. 7. Eficacitatea standardizării, exprimată în efect economic sau social. 8. Armonizarea standardelor cu cerințele reglementărilor tehnice. 9. Claritatea și lipsa de ambiguitate a formulării prevederilor standardului. 10. Complexitatea standardizării obiectelor interconectate. 11. Obiectivitatea verificării cerinţelor.
Principii implementate în timpul standardizării: 6. Dinamismul și dezvoltarea avansată a standardului - document care stabilește caracteristicile produselor și proceselor pentru producerea, exploatarea, depozitarea, transportul, vânzarea și eliminarea acestuia, precum și regulile de implementare a acestora. Dinamismul este asigurat prin revizuirea periodică a documentelor de reglementare, modificări ale acestora sau anulare. Dezvoltarea avansată este facilitată de introducerea în standard a unor cerințe promițătoare pentru produse, procese, metode de control al acestora, indicatori de calitate etc. 7. Eficacitatea standardizării, exprimată în efect economic sau social. 8. Armonizarea standardelor cu cerințele reglementărilor tehnice. 9. Claritatea și lipsa de ambiguitate a formulării prevederilor standardului. 10. Complexitatea standardizării obiectelor interconectate. 11. Obiectivitatea verificării cerinţelor.
 Etapele procedurii de standardizare 1. Selectarea obiectelor de standardizare. 2. Descrierea obiectului, luând în considerare cerințele de bază, adică modelarea acestuia. 3. Optimizarea modelului din punct de vedere al unificării obiectelor folosind metode de sistematizare, tipificare, simplificare (identificarea obiectelor necorespunzătoare), etc. 4. Standardizare model - elaborarea unui document de reglementare (DR) pe baza unui model unificat.
Etapele procedurii de standardizare 1. Selectarea obiectelor de standardizare. 2. Descrierea obiectului, luând în considerare cerințele de bază, adică modelarea acestuia. 3. Optimizarea modelului din punct de vedere al unificării obiectelor folosind metode de sistematizare, tipificare, simplificare (identificarea obiectelor necorespunzătoare), etc. 4. Standardizare model - elaborarea unui document de reglementare (DR) pe baza unui model unificat.
 Astfel, documentul final de standardizare este un document normativ care stabilește regulile principii generale sau caracteristicile diferitelor activități sau rezultatele acestora. Termenul „document de reglementare” este generic și acoperă concepte precum standardele și alte documente normative privind standardizarea: reguli, recomandări, coduri de practică, clasificatoare integral rusești.
Astfel, documentul final de standardizare este un document normativ care stabilește regulile principii generale sau caracteristicile diferitelor activități sau rezultatele acestora. Termenul „document de reglementare” este generic și acoperă concepte precum standardele și alte documente normative privind standardizarea: reguli, recomandări, coduri de practică, clasificatoare integral rusești.
 Un standard este un standard sau o probă luată ca referință pentru compararea altor obiecte similare cu acesta. Standardul ca ND stabilește un set de norme și cerințe pentru obiectul standardizării. Aplicarea standardelor contribuie la imbunatatirea calitatii produsului. Standard - un document în care, în scopul reutilizării voluntare, sunt stabilite caracteristicile produsului, regulile de implementare și caracteristicile proceselor, producție, exploatare, depozitare, transport, vânzare și eliminare, efectuarea lucrărilor sau prestarea de servicii. Standardul poate conține cerințe privind terminologia, simbolurile, ambalajele, marcarea sau etichetele și regulile de aplicare a acestora.
Un standard este un standard sau o probă luată ca referință pentru compararea altor obiecte similare cu acesta. Standardul ca ND stabilește un set de norme și cerințe pentru obiectul standardizării. Aplicarea standardelor contribuie la imbunatatirea calitatii produsului. Standard - un document în care, în scopul reutilizării voluntare, sunt stabilite caracteristicile produsului, regulile de implementare și caracteristicile proceselor, producție, exploatare, depozitare, transport, vânzare și eliminare, efectuarea lucrărilor sau prestarea de servicii. Standardul poate conține cerințe privind terminologia, simbolurile, ambalajele, marcarea sau etichetele și regulile de aplicare a acestora.
 Clasificarea standardelor în funcție de domeniul de aplicare 1. internațional, adoptat de o organizație internațională. 2. național, aprobat de organismul național al Federației Ruse pentru standardizare. 3. stat (industrie), pus în aplicare de către autoritatea executivă a statului. De exemplu, standardele educaționale de stat sunt domeniul de competență al Ministerului Educației al Federației Ruse. 4. standard de întreprindere.
Clasificarea standardelor în funcție de domeniul de aplicare 1. internațional, adoptat de o organizație internațională. 2. național, aprobat de organismul național al Federației Ruse pentru standardizare. 3. stat (industrie), pus în aplicare de către autoritatea executivă a statului. De exemplu, standardele educaționale de stat sunt domeniul de competență al Ministerului Educației al Federației Ruse. 4. standard de întreprindere.
 Standardul de calitate al medicamentului este un document de reglementare care conține o listă de indicatori și metode standardizate de control al calității medicamentelor, aprobate de ministerul sectorial.
Standardul de calitate al medicamentului este un document de reglementare care conține o listă de indicatori și metode standardizate de control al calității medicamentelor, aprobate de ministerul sectorial.
 Standarde de calitate pentru medicamente Prevederile standardelor sunt obligatorii pentru organizațiile de dezvoltare a medicamentelor și producătorii apartenența departamentală, statut juridicși formele de proprietate, precum și pentru organizațiile și instituțiile care efectuează examinarea standardelor de calitate a medicamentelor.
Standarde de calitate pentru medicamente Prevederile standardelor sunt obligatorii pentru organizațiile de dezvoltare a medicamentelor și producătorii apartenența departamentală, statut juridicși formele de proprietate, precum și pentru organizațiile și instituțiile care efectuează examinarea standardelor de calitate a medicamentelor.
 Standardul nu se aplică dezvoltării și producerii de produse farmaceutice: - din sânge și înlocuitori ai acestuia utilizați pentru transfuziologie; - din materii prime de origine animala, utilizate numai pentru prepararea produselor supuse in continuare prelucrare industrială pentru prepararea medicamentelor; - productie straina; - fabricat in farmacii.
Standardul nu se aplică dezvoltării și producerii de produse farmaceutice: - din sânge și înlocuitori ai acestuia utilizați pentru transfuziologie; - din materii prime de origine animala, utilizate numai pentru prepararea produselor supuse in continuare prelucrare industrială pentru prepararea medicamentelor; - productie straina; - fabricat in farmacii.
 Standardele de calitate care stabilesc cerințe pentru medicamente sunt împărțite în următoarele categorii: - Standarde de calitate de stat pentru medicamente (GSKLS); - Articol de farmacopeea întreprinderii (FSP) privind medicamentele unei anumite întreprinderi.
Standardele de calitate care stabilesc cerințe pentru medicamente sunt împărțite în următoarele categorii: - Standarde de calitate de stat pentru medicamente (GSKLS); - Articol de farmacopeea întreprinderii (FSP) privind medicamentele unei anumite întreprinderi.
 Standarde de calitate de stat Ø articol farmacopee generală (GPM) - include o listă de indicatori normalizați sau metode de testare pentru o anumită formă de dozare, o descriere a metodelor fizice, fizico-chimice, biochimice, biologice, microbiologice de analiză a medicamentelor, cerințe pentru reactivii utilizați , solutii titrate, indicatori. Ø monografia farmacopeei (FS). Dezvoltat pentru medicamente monocomponente cu denumire comună internațională (DCI) și conține lista obligatorie indicatori și metode de control al calității medicamentelor (ținând cont de forma sa de dozare) care îndeplinesc cerințele principalelor farmacopei străine. Ø OFS și FS constituie Farmacopeea de Stat (SP).
Standarde de calitate de stat Ø articol farmacopee generală (GPM) - include o listă de indicatori normalizați sau metode de testare pentru o anumită formă de dozare, o descriere a metodelor fizice, fizico-chimice, biochimice, biologice, microbiologice de analiză a medicamentelor, cerințe pentru reactivii utilizați , solutii titrate, indicatori. Ø monografia farmacopeei (FS). Dezvoltat pentru medicamente monocomponente cu denumire comună internațională (DCI) și conține lista obligatorie indicatori și metode de control al calității medicamentelor (ținând cont de forma sa de dozare) care îndeplinesc cerințele principalelor farmacopei străine. Ø OFS și FS constituie Farmacopeea de Stat (SP).
 GF - colecție standardele de stat calitatea medicamentelor, care este de natură legislativă. Fondul Global se bazează pe principiile asistenței medicale naționale și reflectă realizările moderne în domeniul farmaciei, medicinei, chimiei și altor științe conexe. Fondul Global este parte integrantă a unui sistem cuprinzător de asigurare a calității produselor farmaceutice, cerințele sale fiind obligatorii pentru toate întreprinderile și instituțiile implicate în domeniul circulației medicamentelor, indiferent de proprietate și subordonare departamentală.
GF - colecție standardele de stat calitatea medicamentelor, care este de natură legislativă. Fondul Global se bazează pe principiile asistenței medicale naționale și reflectă realizările moderne în domeniul farmaciei, medicinei, chimiei și altor științe conexe. Fondul Global este parte integrantă a unui sistem cuprinzător de asigurare a calității produselor farmaceutice, cerințele sale fiind obligatorii pentru toate întreprinderile și instituțiile implicate în domeniul circulației medicamentelor, indiferent de proprietate și subordonare departamentală.
 Unul dintre standardele fundamentale ale acestui nivel este Farmacopeea Internațională (IP), care stabilește standarde acceptabile pentru potența, puritatea și calitatea produselor farmaceutice care intră pe piață. piata internationala. MF este o alternativă la unele dintre farmacopeile naționale și regionale aplicabile pe scară largă. Scopul său principal este de a se adapta la nevoile țărilor în curs de dezvoltare, oferind standarde de calitate fiabile bazate pe metode clasice, oferind astfel garanții de stat pentru medicamente. Principalele linii directoare pentru dezvoltarea standardelor naționale de calitate pentru medicamente sunt Farmacopeea Europeană, Farmacopeea Britanică și Farmacopeea SUA.
Unul dintre standardele fundamentale ale acestui nivel este Farmacopeea Internațională (IP), care stabilește standarde acceptabile pentru potența, puritatea și calitatea produselor farmaceutice care intră pe piață. piata internationala. MF este o alternativă la unele dintre farmacopeile naționale și regionale aplicabile pe scară largă. Scopul său principal este de a se adapta la nevoile țărilor în curs de dezvoltare, oferind standarde de calitate fiabile bazate pe metode clasice, oferind astfel garanții de stat pentru medicamente. Principalele linii directoare pentru dezvoltarea standardelor naționale de calitate pentru medicamente sunt Farmacopeea Europeană, Farmacopeea Britanică și Farmacopeea SUA.
 Articolul farmacopee al întreprinderii (FSP) este un standard de calitate pentru medicament sub o denumire comercială, care conține o listă de indicatori și metode de control al calității unui medicament produs de o anumită întreprindere, ținând cont de tehnologia specifică acestei întreprinderi și înregistrat în mod corespunzător.
Articolul farmacopee al întreprinderii (FSP) este un standard de calitate pentru medicament sub o denumire comercială, care conține o listă de indicatori și metode de control al calității unui medicament produs de o anumită întreprindere, ținând cont de tehnologia specifică acestei întreprinderi și înregistrat în mod corespunzător.
 FSP, creat de organizația de dezvoltare sau întreprinderea producătoare în legătură cu producția sa, face obiectul dreptului de autor al acestora. FSP conține o listă de indicatori de calitate ai unei substanțe sau a unui medicament fabricat de o anumită întreprindere, cu o descriere detaliată a metodelor de evaluare a acestuia. Astfel, acest document reflectă tehnologia specifică a unei anumite întreprinderi în producție produse specifice, a promovat examenul și înregistrarea de stat. Normele specificate în FSP pot fi mult mai stricte, dar nu mai mici decât cerințele prevăzute în OFS. Standardele întreprinderii pot diferi de FS prin utilizarea altor metode alternative mai economice, mai rapide, automate sau mai precise de analiză și testare; introducerea de caracteristici suplimentare; includere descriere detaliata eșantionarea, care asigură un nivel mai ridicat de standardizare a produselor de serie; folosind toleranțe și limite mai stricte pentru a crea o marjă de siguranță, reduce riscul ca rezultatul să fie în afara intervalului din cauza eterogenității lotului sau a erorii de metodă. Perioada de valabilitate a FSP se stabilește la aprobarea acestuia, ținând cont de nivelul procesului tehnologic al unei anumite producții de droguri, dar nu mai mult de 5 ani.
FSP, creat de organizația de dezvoltare sau întreprinderea producătoare în legătură cu producția sa, face obiectul dreptului de autor al acestora. FSP conține o listă de indicatori de calitate ai unei substanțe sau a unui medicament fabricat de o anumită întreprindere, cu o descriere detaliată a metodelor de evaluare a acestuia. Astfel, acest document reflectă tehnologia specifică a unei anumite întreprinderi în producție produse specifice, a promovat examenul și înregistrarea de stat. Normele specificate în FSP pot fi mult mai stricte, dar nu mai mici decât cerințele prevăzute în OFS. Standardele întreprinderii pot diferi de FS prin utilizarea altor metode alternative mai economice, mai rapide, automate sau mai precise de analiză și testare; introducerea de caracteristici suplimentare; includere descriere detaliata eșantionarea, care asigură un nivel mai ridicat de standardizare a produselor de serie; folosind toleranțe și limite mai stricte pentru a crea o marjă de siguranță, reduce riscul ca rezultatul să fie în afara intervalului din cauza eterogenității lotului sau a erorii de metodă. Perioada de valabilitate a FSP se stabilește la aprobarea acestuia, ținând cont de nivelul procesului tehnologic al unei anumite producții de droguri, dar nu mai mult de 5 ani.
 Examinarea tuturor ND creată și revizuită este efectuată de Comitetul de farmacopee. Dacă este necesar, de comun acord cu producătorul, organizațiile specializate pot fi implicate în efectuarea de verificări experimentale ale standardelor de calitate a medicamentelor. În timpul examinării, aceștia verifică: - nivelul științific și tehnic al proiectului de standard și conformitatea acestuia cerințe moderne Edițiile GF XI și GF XII; - Valabilitatea listei indicatorilor de calitate; - optimitatea valorilor standardelor de calitate și termenului de valabilitate al medicamentelor; - acuratețea și lipsa de ambiguitate a termenilor utilizați, definițiilor, nomenclaturii chimice și unităților de mărime fizică.
Examinarea tuturor ND creată și revizuită este efectuată de Comitetul de farmacopee. Dacă este necesar, de comun acord cu producătorul, organizațiile specializate pot fi implicate în efectuarea de verificări experimentale ale standardelor de calitate a medicamentelor. În timpul examinării, aceștia verifică: - nivelul științific și tehnic al proiectului de standard și conformitatea acestuia cerințe moderne Edițiile GF XI și GF XII; - Valabilitatea listei indicatorilor de calitate; - optimitatea valorilor standardelor de calitate și termenului de valabilitate al medicamentelor; - acuratețea și lipsa de ambiguitate a termenilor utilizați, definițiilor, nomenclaturii chimice și unităților de mărime fizică.
 O parte integrantă a setului de documentație depusă Comitetului de farmacopee este o schemă scurtă pentru sinteza medicamentelor cu indicarea solvenților utilizați în procesul de sinteză, precum și în ultima etapă de preparare și purificare. OFS, FS și FSP, după aprobare, sunt înregistrate la o organizație autorizată în acest sens de către Ministerul Sănătății al Rusiei, cu atribuirea unei desemnări. Denumirile OFS și FS constau din denumirea prescurtată a categoriei standard de calitate a medicamentelor, indexul Ministerului Sănătății al Rusiei, numărul de înregistrare atribuit documentului și ultimele două cifre ale anului aprobării sau revizuirii, separate prin o liniuță. Desemnarea FSP, pe lângă parametrii enumerați, include o indicație a unui cod de întreprindere din patru cifre înainte de numărul de înregistrare al documentului. Codul întreprinderii este atribuit la cererea de aprobare a primului FSP. Modificările la standardele de calitate a medicamentelor de toate categoriile se fac în cazurile în care o creștere a nivelului științific și/sau tehnologic permite îmbunătățirea calității medicamentelor sau clarificarea indicatorilor de calitate.
O parte integrantă a setului de documentație depusă Comitetului de farmacopee este o schemă scurtă pentru sinteza medicamentelor cu indicarea solvenților utilizați în procesul de sinteză, precum și în ultima etapă de preparare și purificare. OFS, FS și FSP, după aprobare, sunt înregistrate la o organizație autorizată în acest sens de către Ministerul Sănătății al Rusiei, cu atribuirea unei desemnări. Denumirile OFS și FS constau din denumirea prescurtată a categoriei standard de calitate a medicamentelor, indexul Ministerului Sănătății al Rusiei, numărul de înregistrare atribuit documentului și ultimele două cifre ale anului aprobării sau revizuirii, separate prin o liniuță. Desemnarea FSP, pe lângă parametrii enumerați, include o indicație a unui cod de întreprindere din patru cifre înainte de numărul de înregistrare al documentului. Codul întreprinderii este atribuit la cererea de aprobare a primului FSP. Modificările la standardele de calitate a medicamentelor de toate categoriile se fac în cazurile în care o creștere a nivelului științific și/sau tehnologic permite îmbunătățirea calității medicamentelor sau clarificarea indicatorilor de calitate.
 De exemplu, FS 42 -000 056 - 01 înseamnă: FS - categorie standard - articol de farmacopee; 42 - index al Ministerului Sănătății al Rusiei pentru a desemna documentele de standardizare; 000 056 - numărul de înregistrare al documentului; 01 - ultimele două cifre ale anului aprobării (2001).
De exemplu, FS 42 -000 056 - 01 înseamnă: FS - categorie standard - articol de farmacopee; 42 - index al Ministerului Sănătății al Rusiei pentru a desemna documentele de standardizare; 000 056 - numărul de înregistrare al documentului; 01 - ultimele două cifre ale anului aprobării (2001).
 Metode de standardizare O metodă de standardizare este o tehnică sau un set de tehnici prin care sunt atinse obiectivele standardizării. O metodă universală în domeniul standardizării produselor, proceselor și serviciilor este ordonarea obiectelor de standardizare prin managementul diversității. Ordonarea ca metodă universală constă în metode separate: sistematizare, selecție, simplificare, tastare și optimizare.
Metode de standardizare O metodă de standardizare este o tehnică sau un set de tehnici prin care sunt atinse obiectivele standardizării. O metodă universală în domeniul standardizării produselor, proceselor și serviciilor este ordonarea obiectelor de standardizare prin managementul diversității. Ordonarea ca metodă universală constă în metode separate: sistematizare, selecție, simplificare, tastare și optimizare.
 Sistematizarea obiectelor de standardizare constă într-o clasificare și ierarhizare bazată științific, consistentă a unui set de obiecte de standardizare specifice. Un exemplu de rezultat al muncii de sistematizare a produselor este Clasificator integral rusesc produse (OKP), care sistematizează întregul produse comercializabile pe industrie sub formă de diferite grupuri de clasificare și denumiri specifice de produse.
Sistematizarea obiectelor de standardizare constă într-o clasificare și ierarhizare bazată științific, consistentă a unui set de obiecte de standardizare specifice. Un exemplu de rezultat al muncii de sistematizare a produselor este Clasificator integral rusesc produse (OKP), care sistematizează întregul produse comercializabile pe industrie sub formă de diferite grupuri de clasificare și denumiri specifice de produse.
 Selectarea și simplificarea obiectelor de standardizare este o activitate care constă în selectarea și identificarea unor obiecte specifice care sunt recunoscute ca fiind adecvate pentru producția și utilizarea ulterioară (de exemplu, revizuire de specialitate MD, care ar trebui inclus în lista medicamentelor vitale și esențiale). Procesele de selecție și simplificare se desfășoară în paralel. Ele sunt precedate de clasificarea, clasarea obiectelor, o analiză specială a perspectivelor și compararea obiectelor cu nevoile viitoare.
Selectarea și simplificarea obiectelor de standardizare este o activitate care constă în selectarea și identificarea unor obiecte specifice care sunt recunoscute ca fiind adecvate pentru producția și utilizarea ulterioară (de exemplu, revizuire de specialitate MD, care ar trebui inclus în lista medicamentelor vitale și esențiale). Procesele de selecție și simplificare se desfășoară în paralel. Ele sunt precedate de clasificarea, clasarea obiectelor, o analiză specială a perspectivelor și compararea obiectelor cu nevoile viitoare.
 Tipificarea obiectelor de standardizare este o activitate de creare a obiectelor standard (exemplare), reguli tehnologice, formulare de documentare. Optimizarea obiectelor de standardizare constă în găsirea parametrilor principali optimi (parametrii de destinație), precum și a valorilor tuturor celorlalți indicatori de calitate și economie. Optimizarea obiectelor de standardizare se realizează prin aplicarea unor metode economice și matematice speciale și modele de optimizare. Scopul optimizarii este atingerea gradului optim de ordine si eficienta maxima posibila conform criteriului selectat.
Tipificarea obiectelor de standardizare este o activitate de creare a obiectelor standard (exemplare), reguli tehnologice, formulare de documentare. Optimizarea obiectelor de standardizare constă în găsirea parametrilor principali optimi (parametrii de destinație), precum și a valorilor tuturor celorlalți indicatori de calitate și economie. Optimizarea obiectelor de standardizare se realizează prin aplicarea unor metode economice și matematice speciale și modele de optimizare. Scopul optimizarii este atingerea gradului optim de ordine si eficienta maxima posibila conform criteriului selectat.
 Probe standard În funcție de scop, se disting următoarele tipuri de eșantioane de comparație: - eșantioane pentru aprecierea acurateței analizei - sunt folosite pentru a aprecia corectitudinea și, uneori, precizia analizei; - probele de calibrare sunt utilizate la construirea unei caracteristici de calibrare; RM-urile, în funcție de scopul aplicării, sunt împărțite în grupuri: 1. Probe standard de stat (SRM); 2. Probe standard de lucru (RSS); 3. Eșantioane standard de substanțe-martori (SWS).
Probe standard În funcție de scop, se disting următoarele tipuri de eșantioane de comparație: - eșantioane pentru aprecierea acurateței analizei - sunt folosite pentru a aprecia corectitudinea și, uneori, precizia analizei; - probele de calibrare sunt utilizate la construirea unei caracteristici de calibrare; RM-urile, în funcție de scopul aplicării, sunt împărțite în grupuri: 1. Probe standard de stat (SRM); 2. Probe standard de lucru (RSS); 3. Eșantioane standard de substanțe-martori (SWS).
 GSO - compuși special preparați grad înalt puritate, ai căror indicatori standard de calitate sunt reflectați în FS și îndeplinesc cerințele OMS pentru acest RM. Sunt utilizate pentru identificarea medicamentelor prin spectroscopie IR, metode cromatografice, determinarea impurităților specifice și cuantificare substanțe (substanțe) medicamentoase prin HPLC, fotometrie și spectrofotometrie UV. Cel mai adesea folosit în evaluarea calității substanțelor-substanțe medicinale.
GSO - compuși special preparați grad înalt puritate, ai căror indicatori standard de calitate sunt reflectați în FS și îndeplinesc cerințele OMS pentru acest RM. Sunt utilizate pentru identificarea medicamentelor prin spectroscopie IR, metode cromatografice, determinarea impurităților specifice și cuantificare substanțe (substanțe) medicamentoase prin HPLC, fotometrie și spectrofotometrie UV. Cel mai adesea folosit în evaluarea calității substanțelor-substanțe medicinale.
 RSO - substanțe medicinale în serie care îndeplinesc cerințele farmacopeei. Acestea sunt destinate pentru determinarea substanțelor medicamentoase prin metode fizico-chimice în forme de dozare, în timp ce CO în calculele conținutului cantitativ este considerat 100%, precum și pentru efectuarea de teste individuale la evaluarea calității substanțelor. Folosit pentru analiza formelor de dozare.
RSO - substanțe medicinale în serie care îndeplinesc cerințele farmacopeei. Acestea sunt destinate pentru determinarea substanțelor medicamentoase prin metode fizico-chimice în forme de dozare, în timp ce CO în calculele conținutului cantitativ este considerat 100%, precum și pentru efectuarea de teste individuale la evaluarea calității substanțelor. Folosit pentru analiza formelor de dozare.
 Probele standard de substanțe-martori (SWS) - sunt utilizate pentru determinarea impurităților sau stabilirea compoziției componentelor medicamentelor. GSO RSO sau alte substanțe special fabricate și certificate pot fi utilizate ca SSMS.
Probele standard de substanțe-martori (SWS) - sunt utilizate pentru determinarea impurităților sau stabilirea compoziției componentelor medicamentelor. GSO RSO sau alte substanțe special fabricate și certificate pot fi utilizate ca SSMS.
 Probele standard sunt utilizate în următoarele tipuri de tehnici analitice: - spectroscopie IR pentru identificarea medicamentelor; - spectrofotometrie UV pentru determinare cantitativă; - determinarea cantitativă pe baza măsurării intensităţii culorii; - metode de separare cromatografică pentru identificare și cuantificare; - metode cantitative, pe baza metodelor de separare, în funcție de distribuția analitului între fazele de solvent; - metode polarografice şi polarimetrice.
Probele standard sunt utilizate în următoarele tipuri de tehnici analitice: - spectroscopie IR pentru identificarea medicamentelor; - spectrofotometrie UV pentru determinare cantitativă; - determinarea cantitativă pe baza măsurării intensităţii culorii; - metode de separare cromatografică pentru identificare și cuantificare; - metode cantitative, pe baza metodelor de separare, în funcție de distribuția analitului între fazele de solvent; - metode polarografice şi polarimetrice.
 Introducerea RM în practica analizei farmaceutice permite realizarea unui număr de soluții pozitive: 1. Aplicați cele mai recente metode cercetare. 2. Asigurați uniformitatea măsurătorilor. Se știe că rezultatele analizei aceluiași medicament, efectuate pe instrumente diferite, care diferă ca sensibilitate și rezoluție, pot da discrepanțe semnificative. Este posibil să se excludă influența unei erori instrumentale folosind RM, deoarece conținutul de substanțe din standarde este cunoscut și determinarea se reduce la compararea preparatului analizat cu standardul în aceleași condiții. 3. Simplificați și accelerați măsurătorile, care decurge din cea precedentă.
Introducerea RM în practica analizei farmaceutice permite realizarea unui număr de soluții pozitive: 1. Aplicați cele mai recente metode cercetare. 2. Asigurați uniformitatea măsurătorilor. Se știe că rezultatele analizei aceluiași medicament, efectuate pe instrumente diferite, care diferă ca sensibilitate și rezoluție, pot da discrepanțe semnificative. Este posibil să se excludă influența unei erori instrumentale folosind RM, deoarece conținutul de substanțe din standarde este cunoscut și determinarea se reduce la compararea preparatului analizat cu standardul în aceleași condiții. 3. Simplificați și accelerați măsurătorile, care decurge din cea precedentă.
 Introducerea RM în practica analizei farmaceutice face posibilă realizarea unui număr de soluții pozitive: 4. Creșterea acurateței și fiabilității metodelor de analiză. 5. Dezvoltați metode automate de control al calității. 6. Realizarea corectitudinii rezultatelor măsurătorilor cantităților care caracterizează compoziția și proprietățile substanțelor și posibilitatea calibrării fiabile a instrumentelor analitice.
Introducerea RM în practica analizei farmaceutice face posibilă realizarea unui număr de soluții pozitive: 4. Creșterea acurateței și fiabilității metodelor de analiză. 5. Dezvoltați metode automate de control al calității. 6. Realizarea corectitudinii rezultatelor măsurătorilor cantităților care caracterizează compoziția și proprietățile substanțelor și posibilitatea calibrării fiabile a instrumentelor analitice.
 Un eșantion de referință este o substanță utilizată pentru a asigura calitatea măsurătorilor (calibrare, certificare a metodelor, evaluarea caracteristicilor statistice ale procesului de măsurare etc.) Probele de comparație pot fi împărțite condiționat în eșantioane de comparație de compoziție simplă și complexă.
Un eșantion de referință este o substanță utilizată pentru a asigura calitatea măsurătorilor (calibrare, certificare a metodelor, evaluarea caracteristicilor statistice ale procesului de măsurare etc.) Probele de comparație pot fi împărțite condiționat în eșantioane de comparație de compoziție simplă și complexă.
 Probele de comparație de compoziție simplă sunt substanțe pure și soluțiile lor. Probele de comparație de compoziție complexă se numesc eșantioane multicomponente care sunt apropiate de compoziția și proprietățile probelor de rutină. Sunt preparate pe baza de substanțe de aceeași natură cu probe de rutină.
Probele de comparație de compoziție simplă sunt substanțe pure și soluțiile lor. Probele de comparație de compoziție complexă se numesc eșantioane multicomponente care sunt apropiate de compoziția și proprietățile probelor de rutină. Sunt preparate pe baza de substanțe de aceeași natură cu probe de rutină.

 Stabilitatea probelor de referință constă în faptul că modificarea parametrilor determinați (concentrația analiților) din momentul certificării până la momentul utilizării ar trebui să fie mică în comparație cu eroarea probei de referință. Este adesea necesară o manipulare specială pentru a asigura stabilitatea. De exemplu, la soluțiile de substanțe organice se adaugă substanțe care împiedică oxidarea lor și au proprietăți bactericide (soluția de glucoză se stabilizează cu acid benzoic); lichidele sunt sigilate ermetic pentru a evita evaporarea (lidate în fiole); probele instabile sunt depozitate și trimise la temperatură scăzută, liofilizate etc.
Stabilitatea probelor de referință constă în faptul că modificarea parametrilor determinați (concentrația analiților) din momentul certificării până la momentul utilizării ar trebui să fie mică în comparație cu eroarea probei de referință. Este adesea necesară o manipulare specială pentru a asigura stabilitatea. De exemplu, la soluțiile de substanțe organice se adaugă substanțe care împiedică oxidarea lor și au proprietăți bactericide (soluția de glucoză se stabilizează cu acid benzoic); lichidele sunt sigilate ermetic pentru a evita evaporarea (lidate în fiole); probele instabile sunt depozitate și trimise la temperatură scăzută, liofilizate etc.
 Stabilitatea probelor de referință este de obicei exprimată sub forma termenului de valabilitate - timpul în care eroarea asociată cu instabilitatea nu depășește o valoare acceptabilă. Omogenitatea (omogenitatea) probelor de referință este o proprietate exprimată în constanța concentrației analiților. Adecvarea este de obicei necesară pentru probele de comparație de compoziție complexă și constă în faptul că sunt apropiate din punct de vedere analitic de probele de rutină.
Stabilitatea probelor de referință este de obicei exprimată sub forma termenului de valabilitate - timpul în care eroarea asociată cu instabilitatea nu depășește o valoare acceptabilă. Omogenitatea (omogenitatea) probelor de referință este o proprietate exprimată în constanța concentrației analiților. Adecvarea este de obicei necesară pentru probele de comparație de compoziție complexă și constă în faptul că sunt apropiate din punct de vedere analitic de probele de rutină.
 Probe de control și arhivă Prezența probelor de control și de arhivă este necesară în două scopuri: 1. pentru a asigura disponibilitatea unei probe pentru studii analitice; 2. Pentru a vă asigura că proba este completă produse terminate.
Probe de control și arhivă Prezența probelor de control și de arhivă este necesară în două scopuri: 1. pentru a asigura disponibilitatea unei probe pentru studii analitice; 2. Pentru a vă asigura că proba este completă produse terminate.
 Probă de control - o probă prelevată dintr-un lot de materii prime, material de ambalare sau produse finite, care este depozitată pentru analiză în perioada de expirare a lotului, dacă este necesar. Probele prelevate în stadiile intermediare critice (de exemplu, după care sunt de așteptat studii analitice și aprobări de eliberare) și mostrele de produse intermediare care sunt expediate în afara zonei de control a producătorului trebuie păstrate, dacă stabilitatea probelor permite acest lucru. Proiectat pentru analiză și ar trebui să fie ușor disponibil unui laborator care a validat metode pentru efectuarea unei astfel de analize. Numărul de probe de control ar trebui să fie suficient pentru a efectua cel puțin două complete control analitic serie de produse în conformitate cu cerințele stabilite la înregistrarea de stat. Depozitarea probelor de control ale produselor finite și substanțelor farmaceutice ar trebui să fie efectuată în conformitate cu cerințele actelor juridice de reglementare ale Federației Ruse. Condițiile de păstrare trebuie să respecte cerințele stabilite în timpul înregistrării de stat a medicamentului (de exemplu, păstrarea la temperatură scăzută, dacă este necesar).
Probă de control - o probă prelevată dintr-un lot de materii prime, material de ambalare sau produse finite, care este depozitată pentru analiză în perioada de expirare a lotului, dacă este necesar. Probele prelevate în stadiile intermediare critice (de exemplu, după care sunt de așteptat studii analitice și aprobări de eliberare) și mostrele de produse intermediare care sunt expediate în afara zonei de control a producătorului trebuie păstrate, dacă stabilitatea probelor permite acest lucru. Proiectat pentru analiză și ar trebui să fie ușor disponibil unui laborator care a validat metode pentru efectuarea unei astfel de analize. Numărul de probe de control ar trebui să fie suficient pentru a efectua cel puțin două complete control analitic serie de produse în conformitate cu cerințele stabilite la înregistrarea de stat. Depozitarea probelor de control ale produselor finite și substanțelor farmaceutice ar trebui să fie efectuată în conformitate cu cerințele actelor juridice de reglementare ale Federației Ruse. Condițiile de păstrare trebuie să respecte cerințele stabilite în timpul înregistrării de stat a medicamentului (de exemplu, păstrarea la temperatură scăzută, dacă este necesar).
 Probă de arhivă - o probă din pachetul final, selectată dintr-o serie de produse finite, care este stocată în scopul confirmării identității. De exemplu, pe durata de valabilitate a unui lot, poate fi necesar să se inspecteze proba sau ambalajul, etichetarea, instrucțiunile de utilizare, obținerea de informații despre numărul lotului și data de expirare. Probele de arhivă trebuie să reprezinte o serie de medicamente finite în forma în care sunt vândute în Federația Rusă și pot fi utilizate pentru control pentru a confirma conformitatea cu cerințele stabilite în timpul înregistrării de stat. Se recomandă depozitarea mostrelor de arhivă la locul unde se află persoana împuternicită care a eliberat autorizația de eliberare a produselor.
Probă de arhivă - o probă din pachetul final, selectată dintr-o serie de produse finite, care este stocată în scopul confirmării identității. De exemplu, pe durata de valabilitate a unui lot, poate fi necesar să se inspecteze proba sau ambalajul, etichetarea, instrucțiunile de utilizare, obținerea de informații despre numărul lotului și data de expirare. Probele de arhivă trebuie să reprezinte o serie de medicamente finite în forma în care sunt vândute în Federația Rusă și pot fi utilizate pentru control pentru a confirma conformitatea cu cerințele stabilite în timpul înregistrării de stat. Se recomandă depozitarea mostrelor de arhivă la locul unde se află persoana împuternicită care a eliberat autorizația de eliberare a produselor.
 În multe cazuri, mostrele de control și de arhivare ale produselor finite sunt identice și sunt unități de producție în pachetul final. În astfel de cazuri, probele de control și de arhivă pot fi considerate ca fiind interschimbabile. Probele de control și de arhivă caracterizează o serie de produse finite sau materii prime și materiale, constituie un atașament la dosar pentru o serie și pot fi evaluate în cazul unei pretenții privind calitatea unui medicament, verificarea conformității cu cerințele stabilite. în timpul înregistrării de stat, verificarea etichetării și ambalării sau verificarea de către o autoritate executivă federală autorizată (inspectorat).
În multe cazuri, mostrele de control și de arhivare ale produselor finite sunt identice și sunt unități de producție în pachetul final. În astfel de cazuri, probele de control și de arhivă pot fi considerate ca fiind interschimbabile. Probele de control și de arhivă caracterizează o serie de produse finite sau materii prime și materiale, constituie un atașament la dosar pentru o serie și pot fi evaluate în cazul unei pretenții privind calitatea unui medicament, verificarea conformității cu cerințele stabilite. în timpul înregistrării de stat, verificarea etichetării și ambalării sau verificarea de către o autoritate executivă federală autorizată (inspectorat).
 Producătorul, importatorul sau întreprinderea la care se eliberează permisiunea de eliberare a lotului trebuie să păstreze controlul și (sau) probele de arhivă ale fiecărui lot de produse finite, producătorul - mostre de control ale fiecărui lot de materii prime și (sau) produse intermediare. Pe fiecare loc de producție compania de ambalare trebuie să păstreze mostre de control pentru fiecare lot de primare materiale de ambalareși materiale tipărite. Este permisă includerea materialelor tipărite în compoziția eșantioanelor de control și (sau) de arhivă ale produselor finite.
Producătorul, importatorul sau întreprinderea la care se eliberează permisiunea de eliberare a lotului trebuie să păstreze controlul și (sau) probele de arhivă ale fiecărui lot de produse finite, producătorul - mostre de control ale fiecărui lot de materii prime și (sau) produse intermediare. Pe fiecare loc de producție compania de ambalare trebuie să păstreze mostre de control pentru fiecare lot de primare materiale de ambalareși materiale tipărite. Este permisă includerea materialelor tipărite în compoziția eșantioanelor de control și (sau) de arhivă ale produselor finite.
 Probele de control și arhivare din fiecare lot de produse finite trebuie păstrate cel puțin pentru data de expirare a lotului și un an de la data expirării. Eșantionul de control trebuie ambalat în ambalajul original. Probele de materii prime (cu excepția solvenților, gazelor sau apei destinate în scopuri tehnologice) trebuie depozitate timp de cel puțin doi ani de la eliberarea medicamentului, cu excepția cazului în care actele juridice de reglementare relevante ale Federației Ruse prevăd o perioadă mai lungă. .
Probele de control și arhivare din fiecare lot de produse finite trebuie păstrate cel puțin pentru data de expirare a lotului și un an de la data expirării. Eșantionul de control trebuie ambalat în ambalajul original. Probele de materii prime (cu excepția solvenților, gazelor sau apei destinate în scopuri tehnologice) trebuie depozitate timp de cel puțin doi ani de la eliberarea medicamentului, cu excepția cazului în care actele juridice de reglementare relevante ale Federației Ruse prevăd o perioadă mai lungă. .
Obiectele standardizării în domeniul circulației medicamentelor sunt medicamentele și activitățile legate de:
organizarea controlului producției și calității medicamentelor;
procesul de organizare a furnizării de medicamente la nivel federal și regional;
fabricarea de medicamente de către farmacii;
procesele care au loc în rețeaua de distribuție a mărfurilor;
informații despre droguri pentru consumatori;
furnizarea de medicamente în sistemul unității de sănătate;
utilizarea rațională a medicamentelor, precum și activitățile farmaciilor.
Organizarea producției și controlului calității medicamentelor este reglementată de Standardul industrial OST 42-510-98 - acestea sunt Regulile pentru organizarea producției și controlul calității medicamentelor (GMP) (aprobate de Ministerul Sănătății al Federației Ruse). la 25 februarie 1998).
Documentul este un set de reguli și cerințe pentru organizarea producției și controlului calității medicamentelor în scopuri medicale. Principalele dispoziții se aplică și ultimelor etape ale producției de substanțe medicamentoase destinate fabricării de medicamente finite. În totalitate, cerințele pentru producția de substanțe medicamentoase, precum și anumite grupuri de medicamente, sunt stabilite în documente de reglementare speciale. Regulile sunt obligatorii pentru toți producătorii de medicamente, indiferent de subordonarea lor departamentală sau de forma de proprietate.
Standardizarea medicamentelor este principalul garant al calității înalte a acestora în producția de masă și asigură eficacitatea și siguranța utilizării. Baza sistemului de management al calității pentru medicamente este standardizarea.
Certificarea materiilor prime și produselor medicinale se realizează în conformitate cu regulile de certificare în Sistemul de certificare a medicamentelor din sistemul de certificare GOST RF. Aceste Reguli definesc principiile și cerințele de bază referitoare la procedura de certificare a înregistrărilor în teritoriu Federația Rusă medicamente de producție internă și străină pentru a proteja drepturile și interesele consumatorilor și pentru a urmări o politică de stat unitară în domeniul asigurării populației cu medicamente de înaltă calitate și sigure:
I. Procedura de certificare a medicamentelor autohtone si straine
II. Cerințe pentru organismele de certificare
III. Cerințe pentru laboratoarele de control
IV. Menținerea Registrului de Stat al Participanților la Certificarea Medicamentelor
Creare cadrul de reglementareîn acest domeniu, implementează sarcinile de a furniza populației medicamente sigure, eficiente și de înaltă calitate. Furnizarea de medicamente constă în dezvoltarea, testarea, înregistrarea, producerea și vânzarea medicamentelor.
Cerințele pentru dezvoltarea de noi medicamente includ reglementarea tehnologiei de dezvoltare a medicamentelor, studiile lor preclinice și clinice, regulile de înregistrare.
Cerințele de vânzare a medicamentelor reglementează condițiile de depozitare, transport, certificare, comerț cu ridicata și cu amănuntul, furnizarea de medicamente către instituțiile medicale, eliberarea către pacienți. Un exemplu este ordinul Departamentului de Sănătate din Moscova nr. 257 din 25 mai 2004. privind procedura de achiziție, transport, depozitare, contabilitate, distribuire, consum de stupefiante, substanțe psihotrope incluse în Lista II și substanțe psihotrope incluse în Lista III, în conformitate cu legea federală „Cu privire la droguriși substanțe psihotrope» în instituțiile medicale și preventive ale Departamentului de Sănătate din Moscova.
Stat sistem centralizat furnizarea de medicamente în URSS a oferit un anumit nivel de asistență farmaceutică populației prin stricte administrare. Datorită prezenței unui management vertical al sistemului de aprovizionare cu medicamente și a omogenității comerțului cu ridicata și cu amănuntul Calitatea aprovizionării cu medicamente ar putea fi reglementată prin ordine, instrucțiuni și scrisori circulare. Totodată, lipsa de flexibilitate caracteristică reglementării planificate a avut un impact negativ asupra calității furnizării populației cu medicamente.
caracteristică scena modernă dezvoltarea pieței farmaceutice ar trebui să fie considerată apariția lanțurilor de farmacii, formate, de regulă, angrosisti diverse forme de proprietate sau, mult mai rar, de către producătorii ruși.
Întrucât furnizarea de droguri este parte integrantă a întregii sfere a circulației drogurilor și este indisolubil legată de sistemul de control al calității de stat, problemele de standardizare ar trebui abordate împreună cu îmbunătățirea sistemului de control al calității medicamentelor.
Asistența medicală pentru cetățeni se realizează pe baza cerințelor de îndeplinire servicii medicale. Formarea documentelor de reglementare care să permită organizarea furnizării de medicamente are loc pe baza cerințelor minime pentru protocoalele de diagnostic și tratare a bolilor. Aceste documente includ:
Lista medicamentelor vitale și esențiale.
Ghid federal pentru medici privind utilizarea medicamentelor.
Lista cu eliberare preferențială a medicamentelor.
Lista medicamentelor disponibile fără prescripție medicală.
Lista formularului de medicamente din subiectul Federației Ruse.
Lista de formulare a instituțiilor de îngrijire a sănătății.
Sortiment obligatoriu de medicamente pentru farmaciile care deservesc ambulatoriu.
O problemă importantă este asigurarea calității informațiilor despre medicamente. Pentru a rezolva această problemă, a fost elaborat și implementat Standardul industriei 91500.05.0002-2001 „Standard de informare de stat al produsului medicamentos. Dispoziții de bază” (OST GISLS).
Standardul de informare de stat al unui medicament include următoarele elemente structurale:
- - articol farmacopee al medicamentului;
- - Înscrierea în formular a medicamentului;
- - articol clinic si farmacologic;
- - pașaportul medicamentului.
Documente oficiale de înregistrare aprobate de identificare a medicamentului:
1. Certificat de înregistrare - un document de reglementare care confirmă permisiunea oficială pentru circulația acestui medicament pe teritoriul Federației Ruse.
Conține informații despre înregistrarea unui medicament pentru următoarele articole:
- - număr de înregistrare;
- - data înregistrării;
- - nume comercial;
- - INN sau un nume care îl înlocuiește în modul prescris;
- - intreprindere - producator;
- - tara intreprinderii - producator;
- - forma de dozare;
- - dozaj;
- - Numărul FSP.
Certificat de înregistrare - servește ca bază pentru includerea unui medicament în Registrul de stat medicamente.
2. Dovada înregistrării numărului unic de ambalaj al medicamentului - desemnare digitală(cod) în standardul Asociației Internaționale pentru Numerotarea Mărfurilor EAN (UNISCAN), care are o reprezentare grafică corespunzătoare (cod de bare), permite citirea automată a acestuia și identificarea fără ambiguitate. Un cod digital de 13 biți - sub forma unei combinații de linii și spații de diferite lățimi - include coduri: țara, compania care a codificat produsul, produsul în sine și numărul de control.
Documentele de reglementare care reglementează sfera de circulație a medicamentelor sunt elaborate pe baza informațiilor conținute în standardul de informații de stat pentru un medicament. Conformitatea cu GISLS este un criteriu pentru fiabilitatea informațiilor despre un medicament.
Pe baza informațiilor conținute în GISLS, următoarele reguli:
Registrul de stat al medicamentelor - o listă sistematizată a denumirilor și a principalelor caracteristici ale medicamentelor, medicamentelor aprobate pentru utilizare în Federația Rusă;
Instrucțiuni de utilizare a unui medicament - un document oficial care conține informații despre un medicament necesare și suficiente pentru utilizarea medicală eficientă și sigură a acestuia;
Lista medicamentelor vitale și esențiale - o listă sistematică a denumirilor generice de medicamente, inclusiv medicamente, fără a căror utilizare, potrivit experților, în bolile și sindroamele care pun viața în pericol, boala va progresa sau evoluția ei se va agrava, complicații sau deces a pacientului va apărea, precum și medicamente pentru terapia specifică a bolilor semnificative din punct de vedere social;
Orientări federale pentru medici privind utilizarea medicamentelor - o colecție de articole din formulare de medicamente sau fragmente ale acestora incluse în lista medicamentelor vitale și esențiale cu o descriere a schemelor și caracteristicilor utilizării lor într-o anumită boală (sindrom);
Lista de eliberare preferențială a medicamentelor - un document aprobat de autoritatea executivă locală a unei entități constitutive a Federației Ruse, care conține o gamă garantată de medicamente concesionale pentru tratamentul ambulatoriu;
Lista medicamentelor eliberate fără prescripție medicală - un document de reglementare care conține o listă cu numele medicamentelor eliberate fără prescripție medicală;
Lista formularului de medicamente a unei entități constitutive a Federației Ruse - un document care conține o listă de nume de medicamente recomandate pentru utilizare pe teritoriul unei entități constitutive a Federației Ruse;
Lista de formulare a unei instituții de asistență medicală - un document care conține o listă de nume de medicamente recomandate pentru utilizare într-o instituție de asistență medicală;
Gama obligatorie de medicamente pentru farmaciile care deservesc pacienții ambulatori - un document de reglementare care reglementează gama minimă de medicamente necesare pentru a furniza îngrijire medicală, a cărui prezență este obligatorie pentru o organizație de farmacie care deservește ambulatori.
Pentru munca sistematică privind crearea unui sistem de documente de reglementare în domeniul aprovizionării cu medicamente și introducerea în practică a standardelor, este necesară coordonarea activității de standardizare atât în domeniul circulației medicamentelor, cât și în domeniul asistenței medicale în general. Instituțiile științifice specializate, comunitatea farmaceutică și medicală ar trebui să participe activ la această activitate.
Capitolul 13 Standardizare, structura standardelor și procedura de aprobare, înregistrare, licențiere și certificare
În OST 91500.05.001-2000. Standarde de calitate farmaceutică. Dispoziții generale a fost definită o procedură unificată pentru elaborarea, prezentarea, executarea, examinarea, aprobarea, aprobarea și desemnarea standardelor de calitate pentru medicamente.
Schema de implementare a cerințelor OST privind asigurarea controlului de stat al calității medicamentelor este prezentată în fig. 13.1.
Acest OST mai definește că standardele de calitate de stat pentru medicamente poartă denumirea generală „Articol de farmacopee”și vin în următoarele categorii:
Monografia farmacopeei generale (GPM)- include o listă de indicatori normalizați sau metode de testare pentru o anumită formă de dozare, o descriere a metodelor fizice, fizico-chimice, chimice, biochimice, biologice, microbiologice pentru analiza medicamentelor, cerințe pentru reactivii utilizați, soluții titrate, indicatori.
Articol de farmacopee (FS) este dezvoltat pentru un medicament sub o denumire comună internațională, dacă este disponibil (pentru medicamentele monocomponente) și conține o listă obligatorie de indicatori și metode de control al calității (ținând cont de forma sa de dozare) care respectă prevederile de conducere. farmacopei străine.
Dezvoltarea unui articol de farmacopee pentru un medicament original (de proprietate) pe durata protecției brevetului și includerea acestuia în Farmacopeea de stat este posibilă numai cu acordul cu dezvoltatorul medicamentului sau se realizează după expirarea brevetului.
Orez. 13.1. Schemă de implementare a cerințelor OST pentru a asigura controlul de stat al calității medicamentelor (conform Bagirova V.L.)
Articol de farmacopee pentru un medicament al unei anumite întreprinderi (FSP) include o listă de indicatori și metode standardizate de control al calității medicamentelor produse de o anumită întreprindere, ținând cont de cerințele Farmacopeei de stat. Mai mult, indicatorii normalizați nu trebuie să fie mai mici decât cerințele stabilite de Farmacopeea de stat. Perioada de valabilitate a FSP se stabilește ținând cont de nivelul procesului tehnologic al unei anumite producții a unui medicament, dar nu mai mult de 5 ani.
Monografii generaleși articole din farmacopee pentru medicamente individuale constitui Farmacopeea de stat (FG), care trebuie publicat de către agenția federală relevantă și republicat la fiecare cinci ani.
În prezent, Farmacopeea de stat a ediției URSS a XI-a este standardul național în Rusia. Pregătirea pentru lansarea ediției GF XII.
Unul dintre principalele standarde internaționale pentru medicamente este introdus în 1996. Farmacopeea Europeana, care este menită să asigure sănătatea publică a populaţiei prin crearea unor standarde publice care reglementează calitatea medicamentelor.
Membrii OMS pot folosi Farmacopeea internațională, care reglementează standarde acceptabile pentru potența, puritatea și calitatea produselor farmaceutice care intră pe piața internațională. O trăsătură distinctivă a acestui standard din farmacopeile naționale este utilizarea metodelor dezvoltate pe baza metodelor clasice de control al calității medicamentelor. Acest lucru le face disponibile și țărilor în curs de dezvoltare. Metodele sunt ușor de implementat și nu necesită costuri mari de material.
13.1. Structura și conținutul standardelor pentru medicamente și materii prime din plante medicinale
După cum sa menționat mai devreme, articolele din farmacopee reprezintă standardele de calitate pentru substanțe, medicamente și materii prime din plante medicinale. Excepție fac materiile prime din plante medicinale (angro), pentru care se obișnuiește din punct de vedere istoric să se formuleze standarde de calitate sub formă de GOST.
13.1.1 Cerințe generale la structura şi conţinutul monografiilor farmacopee
Cerințele generale privind structura și conținutul monografiilor farmacopeei pentru substanțe, medicamente și materii prime ambalate din plante medicinale sunt următoarele:
1. Denumirea produsului în limba rusă este dată în titlul standardului.
În denumirea produsului, primul cuvânt trebuie să fie denumirea substanței active (în cazul nominativ) sau denumirea comercială (în cazul nominativ), urmată de denumirea formei de dozare, dozaj (concentrație), volum . De exemplu: Analgin tablete 0,5 g sau Analgin injectabil 25%.
Lista secțiunilor principale ale FS și FSP și secvența prezentării lor este determinată de forma de dozare specifică.
Toți indicatorii de calitate a produselor conținute în FSP trebuie să fie prezentați într-un tabel rezumat (specificație). Specificația este o parte obligatorie a FSP.
Numerotarea secțiunilor OFS, FS și FSP nu este indicată.
Prezentarea textului trebuie să fie scurtă, fără repetare și să excludă posibilitatea unor interpretări diferite.
Abrevierile cuvintelor din text și legendele sub figuri, diagrame și alte ilustrații nu sunt permise, cu excepția abrevierilor utilizate în legislația Federației Ruse.
În partea de text a standardelor, cerințele pentru calitatea mărfurilor sunt menționate într-o formă imperativă.
La prezentarea cerințelor, normelor și metodelor obligatorii în text, cuvintele trebuie, ar trebui, trebuieși derivate din acestea.
Titlurile secțiunilor sunt plasate pe linia roșie și sunt aldine sau subliniate.
Dacă cerințele, normele, metodele etc., aplicabile medicamentului sunt stabilite în Farmacopeea de stat, în alte standarde de stat sau din industrie, atunci în loc să se repete textul acestora, ar trebui să se ofere un link către sursă.
Prezentarea textului despre substanța utilizată la fabricarea medicamentului trebuie să fie însoțită de o trimitere la documentul de reglementare conform căruia acesta este produs.
Când se descrie compoziția medicamentului, conținutul cantitativ al substanțelor active active și compoziția calitativă a excipienților sunt indicate sub forma unei liste cu referire la documentația de reglementare relevantă care conține cerințele pentru calitatea acestora.
la capitolul " Descriere» stabilirea indicatorilor organoleptici aspect produs medicinal finit (culoare, miros). Nu trebuie folosită definiția: azur, ou etc. Culoarea principală este plasată la sfârșitul definiției.
În capitolul "Dezintegrare" este indicat momentul dezintegrarii complete a unei tablete sau capsule in mediu lichid (in conditiile date in Farmacopeea de Stat).
capitolul " Autenticitate» conține metode de determinare a autenticității substanței active și a produsului în ansamblu. Pentru preparatele cu compoziție complexă, după descrierea definiției necesare, ingredientul identificat este indicat între paranteze.
Secțiuni "Transparenţă"și " Chroma» stabiliți transparența (turbiditatea) și culoarea produsului în comparație cu solventul sau standardul corespunzător.
capitolul " aciditate, alcalinitate" sau "pH" reglementează acești indicatori.
Secțiuni„Reziduu uscat”, „Conținut de alcool”, „Punctul de fierbere”, „Densitate”, „Indice de refracție”, „Unghi de rotație”, „Vâscozitate” limitele superioare și inferioare ale acestor indicatori standard sunt indicate în unitățile de măsură corespunzătoare.
capitolul " Dizolvare" determină cantitatea de substanță activă, care, în condiții date, trebuie să intre în soluție pentru un anumit timp.
la capitolul " Cuantificare» descrie metoda de determinare cantitativa a substantei principale continute in medicament. Această secțiune indică, de asemenea, procentul substanței sau activității principale în unități de acțiune (U / mg) sau micrograme pe miligram (µg / mg) în ceea ce privește substanța activă din medicament sau formele de dozare ale acestuia.
Pentru tablete, sunt indicate limitele conținutului substanței principale în grame dintr-un comprimat, numărând greutatea medie a tabletei, în supozitoare - în grame pe lumânare, în pastile - în grame pe pastilă, în soluții injectabile - în grame la 1 ml.
Cu toate acestea, structura și conținutul PS și PhSP pentru fiecare tip de produs farmaceutic are propriile sale caracteristici. Întrucât în activitatea lor farmacistul, asistenții-șef și asistenții medicali seniori trebuie să poată folosi aceste standarde atunci când acceptă mărfuri, iar studenții Facultății de Învățământ Superior de Asistență Asistentă nu studiază sau lucrează cu aceste documente de reglementare în niciun curs, ne vom opri asupra structurii acestora. și conținutul mai detaliat.
13.12. Structura și conținutul standardelor de stat de calitate pentru substanțe
O monografie din farmacopee pentru o substanță are următoarea structură și conținut:
Numele substanței în rusă
Denumirea comună internațională (INN) în rusă
Denumire chimică în conformitate cu cerințele Uniunii Internaționale pentru Chimie Pură și Aplicată - IUPAC).
Formule structurale și empirice.
Greutatea moleculară relativă.
Descriere (indicatori ai aspectului substanței: stare fizică, culoare, miros, higroscopicitate, sensibilitate la lumină și gaz).
Autenticitate (caracteristicile spectrelor de absorbție UV și IR, reacții calitative specifice etc.).
Solubilitatea (indicatori ai solubilității în apă, alcool 95%, cloroform, eter, alți solvenți, raportul dintre masa substanței dizolvate și volumul solventului).
Temperaturi de topire, solidificare, fierbere, descompunere.
Densitate.
rotație specifică.
Rata specifică de absorbție.
indicele de refracție.
Transparența și culoarea soluției (indicate pentru soluții cu o anumită concentrație; pentru soluții colorate sunt indicate numărul standardului de culoare și litera scalei, caracteristicile spectrelor de absorbție ale soluțiilor).
Aciditatea și alcalinitatea (pH-ul se determină printr-o metodă potențiometrică folosind acizi sau alcalii 0,01-ONE folosind indicatori corespunzători).
incluziuni mecanice.
Impurități străine, indicatori de puritate, solvenți organici reziduali, cenușă sulfatată, metale grele, arsen (metode de detectare, niveluri admisibile de impurități care intră în substanță în timpul producerii acesteia sau se formează în timpul depozitării).
Pierdere la uscare, apă (metoda de realizare a unui studiu conform K. Fischer, norme pentru pierderea de masă la uscare sau conținutul de umiditate).
Toxicitate, pirogenitate, conținut de substanțe asemănătoare histaminei (doze de testare, metode de administrare și perioadă de observare pentru substanțele testate).
Puritatea microbiologică, sterilitatea (metoda de determinare a microorganismelor, limitele admisibile ale acestora).
Determinarea cantitativă a substanței active principale (% conținutul sau activitatea acesteia în unități / mg).
Ambalare (tipul ambalajului primar, numărul de unități de produs în ambalaj primar, ambalaj secundar, numărul de ambalaje primare din acesta, metode de sigilare; sunt furnizate link-uri către documentele de reglementare care determină tipurile și calitatea ambalajelor de grup și de transport etc.).
Etichetare (în conformitate cu cerințele pentru designul grafic al medicamentelor).
Depozitare (sunt indicate condițiile de depozitare a produsului, dacă este necesar, cerințele pentru protejarea produselor de influența factorilor climatici).
Perioada de valabilitate (perioada în care substanța poate fi utilizată).
Acțiune farmacologică, biologică (grupa farmacologică căreia îi este atribuită substanța).
Masuri de precautie.
Numele substanței.
Parte introductivă.
Parte principală.
Totodată, sunt obligatorii clauzele 1.1 - 1.3, 2.1, 2.3, 3.1-3.3, 3.13, 3.15-3.22. Includerea altor articole depinde de natura substanței (substanței) medicinale, de tehnologia de producere a acesteia și de formele de dozare care vor fi făcute din această substanță.
13.1.3. Structura și conținutul standardelor de calitate de stat pentru medicamente
Un articol din farmacopee pentru medicamente are următoarea structură și conținut:
Denumirea chimică a substanței active (pentru materiile prime medicinale ambalate - denumirile rusești și latine ale materiilor prime din plante; pentru extracte - planta din care este făcută materia primă și familia acesteia.
Compoziția medicamentului, indicând conținutul cantitativ de substanțe active active.
Compoziția excipienților (calitativă).
Descriere (indicatori organoleptici ai aspectului medicamentului).
Autenticitate (caracteristicile spectrelor de absorbție UV și IR, reacții calitative specifice etc.).
Dezintegrare (timp de dezintegrare completă a tabletei, capsulei într-un mediu lichid).
Transparență, culoare (transparență, turbiditate, culoarea medicamentului în comparație cu solventul sau standardul).
Aciditate, alcalinitate (pH, determinat potențiometric, folosind acizi sau alcalii 0,01-0,1 N, folosind indicatori corespunzători).
Reziduu uscat, conținut de alcool, punctul de fierbere, densitate, indice de refracție, rotație specifică, vâscozitate (limitele superioare și inferioare ale indicatorilor enumerați).
Dizolvare (cantitatea de substanță activă, care trebuie, în condiții adecvate și într-un anumit timp, să intre în soluție).
Determinare cantitativă (metoda de determinare cantitativă a substanței principale conținute în medicament, % conținut al substanței principale sau activitate în U / mg, μg / mg în ceea ce privește substanța activă; conținut limitativ al substanței principale: pentru tablete - în grame într-un comprimat, pentru supozitoare - în grame pe 1 supozitor, pentru pastile - în grame pe 1 comprimat, în soluții injectabile - în grame pe 1 ml).
Puritatea microbiologică (metoda de determinare a microorganismelor, limitele lor admise).
Ambalare (tipul ambalajului primar, numărul de unități de produs în ambalaj primar, ambalaj secundar, numărul de ambalaje primare din acesta, metode de sigilare; se fac referiri la documentele de reglementare care determină tipurile și calitatea ambalajelor de grup și de transport etc.).
Marcare (dată în conformitate cu cerințele pentru design grafic medicamente).
Perioada de valabilitate (perioada în care medicamentul poate fi utilizat).
Acțiune farmacologică (grupa farmacologică din care face parte medicamentul).
Numele medicamentului în limba rusă.
Parte introductivă.
Parte principală.
13.1.4. Structura și conținutul standardelor pentru materiale de plante medicinale (angro)
GOST pentru plante medicinale (angro) are următoarea structură și conținut:
Numele materialului vegetal medicinal în rusă și latină.
Parte introductivă.
Include numele și domeniul de aplicare al materialului de plante medicinale, al plantei producătoare și al familiei (în rusă și latină).
semne externe ( scurta descriere caracteristicile morfologice ale materiilor prime întregi și zdrobite).
Microscopie (descrierea caracteristicilor de diagnostic ale materiilor prime);
Reacții calitative (metode de reacții chimice calitative sau probe cromatografice).
Indicatori cantitativi (rata procentului de substanțe active, activitate biologică, rate de umiditate, cenușă totală și insolubilă în soluție de acid clorhidric 10%, impurități admisibile și finețe).
Cuantificare (metode de determinare a conținutului de substanțe active).
Puritatea microbiologică (metoda de determinare a microorganismelor, limitele lor admise).
Ambalare (tipul ambalajului primar, numărul de unități de produs în ambalaj primar, ambalaj secundar, numărul de ambalaje primare din acesta, metode de sigilare; se fac referiri la documentele de reglementare care determină tipurile și calitatea ambalajelor de grup și de transport etc.).
Etichetare (furnizată în conformitate cu cerințele pentru designul grafic al medicamentelor).
Depozitare (sunt indicate condițiile de depozitare a produsului, dacă este necesar, cerințele pentru protejarea produselor de influența factorilor climatici).
Perioada de valabilitate (perioada în care pot fi utilizate materiale vegetale medicinale).
Acțiune farmacologică (grupa farmacologică căreia îi sunt atribuite materiale vegetale medicinale).
Parte principală.
Pentru medicamente, la fel ca produsele medicale, există tipuri diferite confirmarea calității produsului la cerințele standardului de stat, acestea includ evaluare a conformității, care include: evaluarea conformității, înregistrarea, acreditarea, controlul și supravegherea etc.
În evaluarea conformității sunt implicate trei grupuri de persoane, care reprezintă două părți interesate (de exemplu, furnizorul și cumpărătorul) și una independentă - o persoană sau un organism care acționează ca arbitru.
Principalele activități în evaluarea conformității sunt confirmarea conformității produselor sau a altor obiecte, procesele de producție, exploatarea, depozitarea, transportul, vânzarea și eliminarea, efectuarea lucrărilor sau prestarea de servicii cu cerințele reglementărilor tehnice, prevederile standardelor sau termenii contractelor. .
Confirmarea conformității poate fi voluntară sau obligatorie. Confirmarea obligatorie se realizează sub forma acceptării unei declarații de conformitate și certificării obligatorii.
13.3. Înregistrarea medicamentelor
În conformitate cu art. I9 din Legea federală nr. 86-FZ din 22/06/98 „Cu privire la medicamente” în Rusia, numai acele medicamente care sunt aprobate pentru utilizare și înregistrate în conformitate cu regulile nr. 10 / 29-14 din 12/01/ 98, care definesc cerințe uniforme, se pot folosi documentația pentru medicamentele autohtone și străine, procedura și condițiile de înregistrare a acestora. În conformitate cu prezenta lege și regulile de înregistrare, sunt supuse înregistrării:
medicamente noi;
noi combinații de medicamente înregistrate anterior;
medicamentele înregistrate anterior, dar produse în alte forme de dozare, cu o nouă doză sau altă compoziție de excipienți;
medicamente generice.
Totodată, pentru acestea din urmă este prevăzută procedura de înregistrare accelerată.
Înregistrarea de stat a unui medicament este efectuată de către Autoritatea Federală pentru Controlul Calității Medicamentului într-o perioadă care nu depășește 6 luni (cu excepția perioadei de studii clinice) de la data depunerii cererii de înregistrare de stat.
Solicitantul poate fi o organizație care dezvoltă un medicament sau altul entitateîn numele dezvoltatorului.
Medicamentele înregistrate sunt înscrise în Registrul de stat al medicamentelor.
Valabilitatea certificatului de înregistrare este de 5 ani cu posibilă reînregistrare ulterioară.
Procedura de înregistrare a medicamentelor în Federația Rusă este un proces foarte costisitor și destul de lung, mai ales atunci când se înregistrează medicamente originale importate și include:
Examinarea prealabilă a dosarului de înregistrare.
Pregatirea dosarului de inregistrare:
traducerea unui număr de documente oficiale, instructive și normativ-tehnice în limba rusă;
pregătirea documentației pentru controlul calității și stabilitatea medicamentului (controlul produsului final) în conformitate cu Farmacopeea Rusă și standardele naționale;
reproducerea materialelor pentru dosar în cantitățile necesare.
Depunerea dosarului la Serviciul Federal privind supravegherea în domeniul sănătăţii şi dezvoltării sociale.
Examinarea (cu participarea comisiilor de specialitate) a materialelor în ceea ce privește siguranța și eficacitatea medicamentului prezentat, posibilitatea înregistrării acestuia în Rusia.
6. Obținerea autorizațiilor de implementare.
13.4. Licențierea activităților de producție și vânzare de produse medicale și farmaceutice
În conformitate cu art. 15 din Legea federală nr. 86-FZ din 22 iunie 1998 „Cu privire la medicamente” și lege federala Nr. 128 din 08.08.01 „Cu privire la licențierea anumitor tipuri de activități” sunt supuse licenței toate companiile farmaceutice implicate în producerea sau circulația medicamentelor pe piața internă, indiferent de proprietate.
Eliberarea unei licențe federale pentru comerţ cu ridicata iar licențele de producție pentru J1C sunt administrate de comisii de licențiere la nivel federal. Cu toate acestea, din cauza numărului mare de entități de piață farmaceutică din țara noastră, Ministerul Sănătății al Federației Ruse și-a folosit și drepturile legislative în scrisorile din 16 iulie 2002 nr. 2510/7125-02-32 „Cu privire la transferul de competențe. să licențieze activități farmaceutice” și Nr. 02-32 „Cu privire la transferul unei părți din competențele de autorizare a activităților legate de circulația stupefiantelor și psihotropelor” a trecut eliberarea licențelor teritoriale pentru comerțul cu ridicata și cu amănuntul la licențierea locală (teritorială). comisioane.
Companiile care obțin licență de fabricare a medicamentelor sunt supuse celor mai înalte cerințe.
Din 1994, Ministerul Sănătății al Rusiei a eliberat peste 500 de licențe pentru producerea de medicamente întreprinderilor și instituțiilor de diferite forme organizatorice și juridice și afiliere departamentală (pentru comparație, până în 1992, doar aproximativ 200 de fabrici și fabrici au desfășurat astfel de activități în întreaga URSS)
Documentele depuse la comisia de licențiere includ:
informatii despre producator; o listă a medicamentelor care urmează să fie produse; diverse informatii tehnologice.
Atunci când se ia o decizie de eliberare (sau refuz de eliberare) a unei licențe, se acordă o atenție deosebită conformării nivelului tehnic de producție cu cel modern, iar pentru noile site-uri de producție este obligatorie respectarea standardului industrial OST 42- 510-98 „Reguli de organizare a producției și controlului calității medicamentelor (GMP)”.
Licența eliberată pentru producția de medicamente este valabilă în toată Rusia. Perioada de valabilitate a acestuia este stabilită de comisia de licențiere, dar nu poate depăși 5 ani. Costurile comisiei de licențiere pentru luarea în considerare și eliberarea unei licențe, precum și pentru examinarea aferentă, se plătesc de către societatea care a solicitat eliberarea licenței.
Licențierea activităților farmaceutice în domeniul comerțului cu ridicata poate fi realizată în două versiuni: cu eliberarea de licențe teritoriale și federale. Prima dintre ele dă dreptul de a desfășura comerț cu ridicata numai pe teritoriul care a emis licența.
Sunt impuse cerințe mai stricte atunci când se eliberează o licență federală care permite comerțul cu ridicata (precum și activitățile conexe, cum ar fi obținerea, depozitarea medicamentelor) în toată Rusia. Licența federală se eliberează numai firmelor care au primit o licență teritorială pentru acest tip de activitate farmaceutică și au lucrat pentru ele timp de cel puțin 6 luni.
Licența federală este eliberată de comisia de licențiere a Ministerului Sănătății și Dezvoltării Sociale din Federația Rusă. Printre documentele necesare obținerii acestuia se asigură o copie a acordului privind controlul calității medicamentelor cu organisme de control și analitice acreditate; certificat de participare la implementarea programelor medicale teritoriale de furnizare de medicamente în teritorii și regiuni; caracteristicile activitatilor societatii eliberate de comisia teritoriala de autorizare; indicatori ai volumului activităților desfășurate. Astfel, comisia de licențiere a Ministerului Sănătății are ocazia să se asigure că firma are o bună reputație pe teritoriul său și, datorită naturii activității sale, are nevoie în mod obiectiv de a obține o licență federală.
Licențierea activităților farmaceutice ale farmaciilor este o modalitate de control de stat asupra respectării cerințelor legislației în domeniul activităților farmaceutice legate de vânzarea medicamentelor. Activitatea unei instituții de farmacie de orice formă de proprietate este interzisă fără licență de stat. Licențiarea activităților farmaciilor se efectuează în strictă conformitate cu legislația în vigoare, precum și cu instrucțiunea Ministerului Sănătății al Federației Ruse din 14 decembrie 1992 „Cu privire la procedura de autorizare a activităților farmaceutice ale farmaciilor și farmaciilor din Federația Rusă."
Pentru obținerea licenței, o instituție de farmacie se adresează comisiei de licențiere care funcționează în cadrul organelor administrației de stat, administrațiilor locale ale orașului și raionale. Astfel, eliberarea licențelor la Moscova se realizează în Camera de Licențiere din Moscova. Pentru a obține o licență de stat, o instituție de farmacie depune următoarele documente comisiei de licențiere:
Afirmație.
O copie a certificatului de înregistrare de stat a instituției (întreprinderii), certificată de un notar.
O copie a Statutului sau a regulamentelor instituției autorizate, aprobată în modul prescris (autentificată la notar).
O copie a comenzii sau a contractului pentru inchirierea unei camere, echipament (autentificat).
Lista tipurilor de activitate farmaceutică, servicii declarate pentru licențiere.
Incheierea supravegherii sanitare de stat.
Incheierea supravegherii incendiilor de stat.
Certificate de acreditare ale instituției și personalului farmaciei.
O copie a licenței eliberate anterior (pentru o instituție care a trecut anterior licența).
O copie a ordinului de plată pentru plata unei taxe unice pentru eliberarea unei licențe.
Procedura de autorizare este stabilită de comisie și prevede:
1) studiul documentelor depuse de farmacie;
efectuarea unei examinări la fața locului;
eliberarea unei licențe.
În cazul în care documentele depuse de farmacie nu îndeplinesc cerințele, acestea sunt returnate solicitantului. Noul termen de examinare se calculează din momentul reprezentării documentelor.
Licența este supusă fiecărui tip de activitate farmaceutică desfășurată de societatea care solicită licență și anume:
producerea tuturor tipurilor de forme de dozare conform prescripțiilor medicilor și cerințelor instituțiilor medicale;
producerea tuturor tipurilor de forme de dozare conform prescripțiilor frecvent repetate ale medicilor în loturi mici;
controlul asupra tehnologiei de fabricare, depozitare, calitate a medicamentelor finite și a medicamentelor fabricate în farmacii, a materialelor de plante medicinale și a preparatelor din acesta;
primirea, depozitarea, organizarea, livrarea, distribuirea medicamentelor și dispozitivelor medicale către farmacii și instituții medicale;
vânzarea către populație și instituții medicale de medicamente (atât fabricate în farmacii, cât și gata făcute) și produse medicale aprobate pentru utilizare în Federația Rusă.
Înainte de a obține o licență, o instituție de farmacie și persoanele care desfășoară activități individuale sau colective în sistemul de furnizare de medicamente trebuie să treacă prin acreditare, care constă în determinarea conformității condițiilor și locului activității lor cu cerințele stabilite pentru farmacii.
13.5. Certificarea medicamentelor
Sistemul de certificare a medicamentelor funcționează în cadrul sistemului de certificare obligatorie stabilit de Standardul de stat al Federației Ruse și condus în prezent de Agenția Federală pentru Reglementare Tehnică și Metrologie.
Temeiul juridic al sistemului de certificare a produselor medicale și farmaceutice include următoarele acte juridice si comenzi:
1. Fundamentele legislației Federației Ruse privind protecția sănătății cetățenilor.
Decretul Guvernului Federației Ruse „Cu privire la licențiere anumite tipuri activitate” (din data de 24. 12. 94 nr. 1418).
Reglementări ale Ministerului Sănătății al Federației Ruse (aprobate prin Decretul Guvernului Federației Ruse din 03.06.97 nr. 659).
Documente aprobate de Ministerul Sănătății al Federației Ruse:
Reguli pentru efectuarea certificării în Federația Rusă.
Modificarea nr. 1 la „Regulile de certificare în Federația Rusă”.
Procedura de efectuare a certificării în Federația Rusă.
Modificarea nr. 1 „Procedura de certificare în Federația Rusă”.
Reguli de utilizare a mărcii de conformitate pentru certificarea obligatorie a produsului etc.
GOST R 40.001-95. Reguli pentru certificarea sistemelor de calitate în Federația Rusă.
GOST R 51000.1-95. Sistemul de stat standardizarea Federației Ruse. Sistemul de acreditare a organismelor de certificare și a laboratoarelor de testare și măsurare. Cerințe generale.
GOST R ISO/IEC 65-2000. Cerințe generale pentru certificarea produsului etc.
Certificarea obligatorie și voluntară se realizează conform schemelor descrise mai sus (a se vedea Capitolul 11, Tabelul 11.4) și reprezintă un set dat de acțiuni acceptate oficial ca dovadă a conformității medicamentelor cu cerințele reglementării tehnice și ale standardului. În funcție de sarcina de certificare, se selectează o schemă și se efectuează verificarea în conformitate cu aceasta.
Perioada de valabilitate a certificatului de conformitate pentru medicament corespunde cu data de expirare. În documentația de însoțire anexată la produsele certificate se face o evidență a certificării, care indică: numărul certificatului, perioada de valabilitate, organismul care l-a eliberat.
Procedura de certificare a medicamentelor este următoarea: 1. Solicitantul depune o cerere la Organismul de Certificare. La cerere se anexează următoarele documente:
certificat de înregistrare al Ministerului Sănătății al Rusiei cu permisiunea de a utiliza J1C în practica medicală;
licență pentru dreptul de fabricație (vânzare) J1C;
un act de prelevare a unei probe medii (prelevarea unei probe medii se efectuează în conformitate cu cerințele articolului „Prelevarea de probe (prelevarea) de medicamente” din Farmacopeea de stat);
protocolul de analiză al producătorului (pentru J1C autohtone) sau certificatul de analiză al unei companii și traducerea acestuia (pentru medicamentele străine) cu rezultatele verificărilor calității medicamentelor pentru conformitatea cu cerințele ND la eliberare.
Solicitantul poate fi o entitate juridică de orice formă de proprietate (sau o persoană fizică) care a obținut, în conformitate cu procedura stabilită, o licență pentru fabricarea, vânzarea sau importarea medicamentelor pe teritoriul Federației Ruse.
În prezent, în toată Federația Rusă, există certificate de conformitate emise de:
Centrul de Certificare a Produselor Medicamentale al Ministerului Sănătății al Rusiei;
Centrul pentru Certificarea și Controlul Calității Produselor Medicamentale din Moscova;
Instituția de sănătate de stat „Centrul de Nord-Vest pentru controlul calității și certificarea produselor medicamentoase”, Sankt Petersburg. În fig. 13.2.
13.6. Aspecte ecologice ale comercializarii medicamentelor
Ecologie- este știința relației dintre organismele vegetale și animale și comunitățile lor între ele și mediu inconjurator. Termenul a fost propus de Haeckel în 1886. În zilele noastre, ecologia a căpătat o semnificație deosebită ca bază științifică pentru utilizarea rațională a resurselor naturale și protecția organismelor vii.
Începând cu anii 1970, ecologia umană sau ecologia socială s-a dezvoltat, studiind modelele de interacțiune dintre societate și mediu, precum și problemele practice ale protecției acestuia. Acesta este de interes:
1. Studiul impactului antropic al mediului extern asupra produsului:
contaminarea materiilor prime și a materialelor (etapa de bază);
poluare în timpul producție tehnologică(etapa tehnologică);
poluarea în timpul transportului și depozitării (etapa de manipulare);
Sksgsna gotnkkavpk GOST R. MINISTERUL SĂNĂTĂȚII AL FEDERATIEI RUSE
DEPLGGLMSHT VESSEL(1""1"QC.>"FYa"MVN<К.Ш, Г.КЮНАСИОСГИ ЛЕКАРСТВЕННЫХ (РЬДСГ» II МЕДИМШСКОЙ ТЕХНИКИ
"m -Da -turnată g os bate tvesh yue "noastre 1 certificare minsh gersgod zd?abs;phgsh;tsh
FEDERAȚIA RUSĂ"
Orez. 13.2. O mostră de completare a unui certificat pentru un medicament.
CERTIFICAT DE CONFORMITATE
" 16 "" iWII.
Fnig Yaymk JAO - SIL yutgtSHINP YATIA"
"K" shmyay lpyauien? yAfltroscpai:j. h> jaekgrsgyeinm înseamnă „
„-N^YASHSHSH
grkk goyaiosgi 19.W0S
j tilemkn W JU, N .itf pinuangle
„.O ^ shtstvokg tloyliiyay SHI” MATCHLOPG. 1 DSMSUMENTL
Itf-" IWS .....
C^JWjf.j^gaf"iJ" tfm m inis* MP. Tsshmyuiya Rusă
<":::Щ„|)IR;1GKijffin TtaiXiiuB^BHH
j^ftirt- tutft/rtorfsm:*YY fv" 17 GJ _
Cpu*jarteTMW«pt»|ai™iir,TO ^..-"f " Zkamga 2£Yah.

Kv tUkCKi K j!
contaminare în timpul utilizării (faza de exploatare).
2. Studiul impactului produsului asupra ecosistemului și asupra oamenilor
poluarea cu produse industriale;
contaminarea ambalajelor;
impactul produsului în sine.
Prin poluare se intelege introducerea in orice mediu (atmosfera, apa, sol, materii prime etc.) a unor agenti noi, nefavorabili, nefavorabili sau excesul acestor agenti in mediu fata de nivelul mediu natural pe termen lung.
Poluarea are loc chimic(gazoși, solizi, lichizi și alți agenți); fizic(termic, electromagnetic, radiații etc.); mecanic(contaminare cu elemente de ambalare); biologic(poluare cu microorganisme, insecte etc.).
În 1989, la facultatea de farmacie a MMA numită după. A fost înființat I.M.Sechenov, Centrul Științific și Metodologic de Analiza Microelementelor a Produselor Medicamentale și a Materiilor Prime Vegetale. Aproximativ 80% din speciile de plante medicinale au fost studiate pentru conținutul de metale grele.
capcane folosind cele mai moderne metode: spectroscopie de absorbție atomică, spectroscopie de emisie atomică, spectroscopie de fluorescență cu raze X etc.
În iunie 1990, a avut loc Primul Simpozion Științific Internațional „Aspecte de mediu în farmacie”, la care a fost adoptată o rezoluție privind crearea programului de stat „Siguranța mediului înconjurător a medicamentelor”, inclusiv crearea de tehnologii ecologice, prelucrarea complexă a materiilor prime. materiale, dezvoltarea lucrărilor de biotehnologie, identificarea și reglarea compușilor de origine antropică din materiile prime medicinale naturale, îmbunătățirea și unificarea metodelor și sistemelor de control, crearea bazelor de date și a sistemelor informaționale regionale. Din anul 2000, la facultăţile de farmaceutică a fost introdus un nou curs „Ecologia medicamentelor”.
Întrebări pentru autocontrol (modulul 4)
Cât de importantă este calitatea produselor medicale și farmaceutice?
Ce tipuri de indicatori de calitate cunoașteți?
Ce documente reglementează calitatea produselor medicale și farmaceutice?
Care este semnificația standardizării ca factor care influențează formarea valorii de utilizare a produselor farmaceutice?
Care sunt scopurile și obiectivele standardizării?
Ce standarde sunt utilizate în rețeaua de farmacii pentru lucrul cu produse farmaceutice, cu excepția medicamentelor? Dă-le o descriere.
Ce standarde sunt utilizate pentru lucrul cu medicamente? Dă-le o descriere.
De ce certificarea afectează valoarea de utilizare a mărfurilor?
Care este semnificația certificării și de ce este necesară în practica farmaceutică?
Ce documente reglementează certificarea medicamentelor?
Care este scopul licențierii activităților medicale și farmaceutice?
Care sunt asemănările și diferențele dintre GOST pentru dispozitive medicale și FS pentru medicamente?
BAZELE ANALIZEI MĂRFURILOR
STANDARDIZARE(ing. normă standard, eșantion, măsură) - procesul de stabilire și aplicare a standardelor, adică un set de documente normative și tehnice care reglementează un set de norme, reguli, cerințe pentru obiectul standardizării, aprobate de autoritatea competentă. S. se desfășoară atât în raport cu obiectele materiale (produse industriale și agricole, standarde, mostre de substanțe) cât și nemateriale (norme, reguli și cerințe în diverse scopuri). Obiectul S. sunt, de asemenea, diverse forme de servicii, metode și mijloace de asigurare a unității și acurateței măsurătorii, terminologia, formele standard de documente, simbolurile, protecția mediului și managementul rațional al naturii etc. Un domeniu special al S. este medicina. , în care medicamentele, alte produse mierea servesc drept obiecte lui S.. destinație, siguranța muncii (vezi mai jos).
Un exemplu tipic din regiunea S. poate servi ca așa-numitul. eșantioane standard, adică substanțe care au valori destul de precise cunoscute și certificate oficial ale proprietăților (parametrilor) specifici unei substanțe date. După scopul lor, ele aparțin clasei mijloacelor metrologice (vezi Metrologie). Ele sunt realizate conform unei tehnologii speciale, iar valorile proprietăților (parametrilor) sunt stabilite pe baza rezultatelor studiilor efectuate conform unui program dat.
Materialele de referință sunt utilizate pe scară largă în extracția și prelucrarea materiilor prime minerale, în controlul materiilor prime și materialelor furnizate în cadrul cooperării economice internaționale, în domeniul sănătății (pentru unificarea analizelor clinice și biochimice), în domeniul mediului. protecția (supravegherea și controlul poluării mediului), etc. d.
În URSS, standardizarea este unul dintre elementele politicii tehnice de stat, strâns legată de sistemul de planificare și management al economiei naționale. Sarcina principală a lui S. în acest caz este stabilirea cerințelor uniforme pentru nivelul tehnic și calitatea produselor, materiilor prime, materialelor, componentelor, precum și standardizarea cerințelor și metodelor de proiectare și fabricare a produselor într-un singur scop. sau alt. Utilizarea standardelor la scară națională ajută la îmbunătățirea calității produselor, asigură creșterea nivelului de unificare și interschimbabilitate, creează cele mai bune oportunități pentru automatizarea anumitor procese de producție și îmbunătățirea condițiilor de muncă.
Sistemul de stat de standarde al URSS unește munca pe S. la toate nivelurile de conducere a economiei naționale. Este un set de reguli și reglementări care unește scopurile și obiectivele S.; organizarea și tehnica realizării S.; procedura de elaborare, implementare și circulație a documentelor de reglementare, precum și efectuarea modificărilor acestora; procedura de supraveghere de stat și control departamental asupra implementării și respectării acestora; S. obiecte, categorii și tipuri de standarde etc. Planificarea tuturor activităților din zona S. este parte integrantă a sistemului de planificare de stat.
Primul document din istoria puterii sovietice în domeniul măsurării a fost decretul Consiliului Comisarilor Poporului din RSFSR (1918) „Cu privire la introducerea sistemului metric internațional de măsuri și greutăți”. Primul standard al Uniunii a fost introdus în URSS în 1926: OST-1 „Grâu. Selecția soiurilor de cereale. Nomenclatură". În anii următori, au fost elaborate și aprobate numeroase standarde, acoperind aproape toate ramurile industriei și agriculturii din Uniunea Sovietică. În 1978, existau deja St. 20 de mii
O trăsătură caracteristică a S. în țara noastră este trecerea de la S. individual la dezvoltarea și implementarea sistemelor intersectoriale de standarde de importanță națională. Acestea includ: Sistemul de standardizare de stat (SSS), Sistemul de măsurare de stat (GSP), Sistemul unificat de documentare a proiectării (ESKD), Sistemul unificat de documentare tehnologică (ESTD), Sistemul unificat de pregătire tehnologică a producției (ESTPP) , Sistemul Unificat de Standarde de Securitate Ocupațională (ESSBT) ), un sistem de standarde pentru protecția mediului etc.. De asemenea, sunt dezvoltate programe pentru protecția integrată a mediului pentru cele mai importante tipuri de produse. Acestea oferă cerințe uniforme pentru nivelul tehnic și calitatea produselor, componentelor, materiilor prime, materialelor și echipamentelor, pentru mijloacele de control, măsurare și testare a produselor etc.
Din 1954, Comitetul de Stat al URSS pentru Standarde (Gosstandart) desfășoară conducerea generală a S. la scară națională și în domeniul medicamentelor, vaccinurilor și serurilor - M3 al URSS. Sistemul de organe și servicii ale Standardului de Stat al URSS include administrații republicane, centre de S. și metrologie, institute de cercetare și laboratoare de supraveghere de stat a conformității cu standardele. Sf. 600 șef, organizațiile de bază ale diferitelor ramuri ale economiei naționale a URSS desfășoară anumite tipuri de lucrări legate de standardizare.
Pe lângă standardul de stat al URSS, M3 al URSS are și dreptul de a se standardiza în domeniul medicinei și al îngrijirii sănătății. Departamentul pentru introducerea de noi medicamente și echipamente medicale M3 al URSS desfășoară C. în legătură cu medicamente, echipamente medicale, echipamente de farmacie, preparate medicale biologice și imunobiologice, precum și o serie de alte măsuri care vizează păstrarea sănătății umane.
Standardele în sine, în funcție de ordinea aprobării, precum și de domeniul de aplicare, au mai multe categorii: standarde de stat (GOST), industrie (OST), republicane (PCT), standarde ale întreprinderilor (asociații) - STP.
Standardele de stat (GOST) sunt aprobate de Comitetul de Stat pentru Standarde al URSS (Gosstandart), cu excepția anumitor tipuri de standarde aprobate de Consiliul de Miniștri al URSS, Comitetul de Stat pentru Construcții al URSS (Gosstroy) și M3 al URSS.
GOST-urile sunt obligatorii pentru toate ministerele, comitetele de stat, departamentele URSS, pentru toate organizațiile de stat, cooperative și alte organizații publice.
Standardele industriale (OST) sunt aprobate de ministerele, comitetele de stat și departamentele din întreaga Uniune și Uniune-Republică ale URSS. Acestea sunt obligatorii pentru toate întreprinderile, organizațiile și instituțiile departamentului care au aprobat standardul relevant. OST pentru produse sunt aprobate de ministere sau departamente, care sunt principalele în proiectarea sau producerea acestui tip de produs, și sunt obligatorii pentru alte ministere (departamente), întreprinderi, organizații și instituții asociate cu producția, dezvoltarea, transportul, depozitare, exploatare a produselor de tip corespunzator.
Standardele republicane (RST) sunt aprobate de consiliile republicane ale miniștrilor din republicile unionale (sau, la instrucțiunile acestora, de către Comitetele de stat de planificare sau departamentele de stat de construcții ale republicilor unionale). PCT sunt obligatorii pentru toate întreprinderile, organizaţiile, instituţiile situate pe teritoriul republicii unionale, indiferent de subordonarea departamentului.
Standardele întreprinderilor sau asociațiilor (STP) sunt obligatorii doar pentru întreprinderea (asociația), organizația și instituția care a aprobat acest tip de standard.
Pe baza standardelor relevante, sunt elaborate specificațiile tehnice (TS), adică un document de reglementare și tehnic (NTD) care stabilește un set de cerințe pentru un anumit tip de produs.
În procesul C., standardele sunt elaborate, aprobate și modificate de organele speciale ale statului în modul prescris de Sistemul de standardizare de stat. Pentru fiecare standard sunt prevăzute termenele de intrare în vigoare, iar domeniul de aplicare este determinat de categoria standardului (adică național, sectorial, republican etc.).
O trăsătură caracteristică a S. este competenţa sa tehnică şi juridică. Acest lucru este tipic pentru S. în ceea ce privește produsele, procesele tehnologice, protecția mediului, siguranța muncii etc. Execuția și controlul asupra respectării standardelor este asigurată de normele relevante ale legii în vigoare, care prevede răspunderea juridică pentru încălcarea prevederilor legale. standard.
În domeniul îngrijirii sănătăţii, există un întreg sistem de acte legislative (vezi Legislaţia sanitară), care asigură respectarea standardelor care vizează păstrarea sănătăţii persoanei sovietice (vezi Sănătatea muncii, Standarde igienice, Protecţia mediului, Protecţia muncii şi altele). articole similare).
O trăsătură caracteristică a stadiului actual de dezvoltare a metricilor în URSS este complexitatea metricilor, care se manifestă prin faptul că, atunci când anumite standarde sunt puse în aplicare, indicatorii standardelor interconectate și momentul intrării lor în vigoare sunt prevăzută. Complexitatea S. este asigurată de dezvoltarea programelor S. care combină produse, semifabricate și materiale, mijloace tehnice, organizarea producției etc.. Complexitatea S. face posibilă utilizarea mai eficientă a posibilități de producție modernă, de a realiza coordonarea intersectorială și de a satisface cerințele părților interesate.
Standardizarea în cadrul CMEA este în concordanță cu sarcinile Programului cuprinzător pentru continuarea aprofundării și îmbunătățirii cooperării și dezvoltării integrării economice socialiste a țărilor membre ale Consiliului de Asistență Economică Reciprocă (CMEA). S. în CMEA se ocupă de Comisia Permanentă pe S., comisiile permanente sectoriale, Institutul CMEA pentru S. și departamentul S. al secretariatului CMEA. Principalele domenii de activitate sunt crearea de sisteme de documente normative și tehnice (sistemul de documentație normativă și tehnică al CMEA pentru S.; sistemul automatizat de informare și control al S. și metrologia CMEA; sistemul unificat de proiectare). documentația CMEA; sistemul unificat de toleranțe și aterizări ale CMEA), precum și standarde complexe privind produsele care fac obiectul comerțului între țările membre CMEA. Normele și cerințele standardelor CMEA corespund standardelor internaționale. Până la 1 ianuarie 1975, au fost adoptate 4.900 de recomandări CMEA privind S. și 120 de standarde CMEA. Cea de-a 28-a sesiune CMEA (21 iunie 1974) a aprobat „Regulamentele privind standardul CMEA (CMEA ST)” și a aprobat Convenția privind aplicarea directă (imediată) a standardelor CMEA. Convenția privind aplicarea ST CMEA a fost ratificată de către Prezidiul Sovietului Suprem al URSS prin decret din 17 septembrie 1974. Elaborarea și aplicarea standardelor CMEA au o influență decisivă asupra intensificării proceselor de integrare economică socialistă, îmbunătățirea diviziunii internaționale socialiste a muncii, creșterea nivelului producției și a calității produselor și întărirea competitivității produselor socialiste pe piețele mondiale și dau un efect economic semnificativ. Utilizarea standardelor CMEA în economiile naționale ale țărilor membre CMEA conduce la o convergență suplimentară a sistemelor naționale de contabilitate.
Standardizarea internațională este asociată cu dezvoltarea cooperării științifice, tehnice și economice multilaterale. Pe lângă organizațiile naționale, peste 300 de organizații internaționale și regionale se ocupă de probleme de măsurare, metrologie și îmbunătățirea calității produselor (1975). Cele mai mari organizații internaționale operează în regiunea S.: Comisia Economică pentru Europa a Națiunilor Unite (UNECE), Organizația Internațională pentru Standardizare (ISO) și Comisia Electrotehnică Internațională (IEC).
Standardele și recomandările internaționale elaborate de aceste organizații stabilesc indicatori care îndeplinesc cerințele științifice și tehnice moderne de calitate, fiabilitate, siguranță și alte proprietăți și caracteristici importante ale diferitelor tipuri de produse care fac obiectul comerțului internațional și, de asemenea, determină metode și mijloace unificate. a materialelor și mărfurilor de testare și certificare. Aplicarea standardelor internaționale contribuie la extinderea relațiilor științifice, tehnice, economice și comerciale. Standardele internaționale sunt utilizate pe scară largă în dezvoltarea standardelor naționale, care pot reduce semnificativ timpul și costul dezvoltării lor și pot obține un efect economic mare.
Standardizarea în medicină
Standardizarea în medicină este dezvoltarea și utilizarea unor norme, reguli, cerințe uniforme în dezvoltarea și implementarea agenților medicinali, imunitari și a altor agenți terapeutici, preventivi și de diagnostic, precum și a echipamentelor medicale. C. contribuie la eficientizarea acestor procese, luând în considerare solicitările și cu participarea tuturor părților interesate. C. se desfășoară ținând cont de realizările științei, tehnologiei, bunelor practici ale instituțiilor medicale, sanitar-epidemiologice, de cercetare, farmacie și ale altor instituții medicale, precum și ale întreprinderilor din industria medicală și din alte industrii care produc produse pentru diagnosticare și prevenire medicală. scopuri. Rezultatele lui S. sunt reflectate în documente normative și tehnice - standarde care sunt obligatorii pentru utilizare, precum și în alte documente cu un scop similar (norme, metode de control al acestora, instrucțiuni, cerințe tehnice medicale, reguli, materiale de reglementare, recomandări metodologice și instrucțiuni) elaborate în modul prescris și aprobate de departamentele relevante ale M3 ale URSS.
Specificații - documente de reglementare și tehnice (NTD) care stabilesc un set de cerințe pentru anumite tipuri, mărci, articole de produse. Specificațiile fac parte integrantă din complexul de documentație tehnică pentru produse, cărora li se aplică. Specificațiile care conțin cerințe referitoare la asigurarea securității muncii și protecția sănătății lucrătorilor și angajaților sunt supuse acordului cu autoritățile sanitare în modul stabilit de M3 al URSS.
Cerințele medicale și tehnice (specificațiile tehnice) sunt dezvoltate pe baza studiului și analizei realizărilor tehnologiei interne și externe, tehnologiei avansate de producție, rezultatelor muncii de cercetare, precum și pe baza cerințelor clientului - M3 de URSS.
Cerințele medico-tehnice (specificațiile tehnice pentru produsele de echipamente medicale și alte produse medicale) sunt aprobate de Administrația pentru introducerea de noi medicamente și echipamente medicale M3 a URSS și de autoritatea căreia îi este subordonată organizația dezvoltatorului.
S. este utilizat în medicină în legătură cu medicamente (vezi Farmacopee, Registrul de stat, Controlul medicamentelor), echipamente farmaceutice (vezi Farmacie), dispozitive medicale și echipamente medicale, precum: unelte, dispozitive, aparate, produse de îngrijire a pacientului, miere. echipament etc. (vezi Echipament medical), miere. preparate biologice și imunobiologice (vezi Standardul bacteriene, Controlul preparatelor bacteriene), alimente (vezi Nutriție), tipuri speciale de îmbrăcăminte (vezi Îmbrăcăminte specială), echipament individual de protecție (vezi). Pe lângă obiectele materiale, S. acoperă în medicină întregul sistem de norme care prescriu sub formă de reguli, scrisori de recomandare (metodologice) cerințe etc., măsuri de igienă și organizare, studii clinice, cercetări de laborator. Acestea includ, de asemenea, cerințele de reglementare prescrise de normele sanitare pentru condițiile de muncă (vezi Sănătatea muncii, Securitatea muncii, Concentrațiile maxime admise, Măsuri de siguranță, Muncă, Ergonomie) și standardele de muncă asociate cu radiații sau pericole toxice (vezi Substanțe radioactive, Igiena radiațiilor, Radiații). siguranța, Toxicologie), starea aerului în spațiile menajere, sportive și în alte spații, calitatea apei, puritatea solului, dimensiunea și calitatea spațiului de locuit (vezi Igiena comunală), emisiile de la întreprinderile industriale (vezi Protecția mediului) și toate celelalte norme care sunt esențiale pentru protecția sănătății publice, precum și cerințele pentru respectarea acestor norme (vezi Standarde igienice, Inspecție sanitară, Legislație sanitară, Stație sanitară și epidemiologică, Supraveghere sanitară). Un loc aparte îl ocupă standardizarea metodelor de măsurare, a echipamentelor de măsurare și a unităților de măsură utilizate (vezi Unități de măsură, Sistem internațional de unități, Serviciul sanitar metrologic, Metrologie, Instrumente de măsurare în scopuri medicale). Pagina se extinde și la miere. documentație (vezi Documentație medicală) și miere. terminologie (vezi Terminologia medicală).
Planificarea lucrărilor de standardizare în domeniul medicinei aparține în principal M3 al URSS. Toate lucrările pe S. în sistemul URSS M3 sunt încredințate Administrației pentru introducerea de noi medicamente și echipamente medicale M3 a URSS. În plus, specialiști relevanți din Direcțiile și Direcțiile principale ale M3 ale URSS participă la lucrările S.: sanitar și epidemiologic, farmacie, îngrijire medicală și preventivă, îngrijire medicală și preventivă pentru copii și mame, infecții de carantină, pt. producția de preparate bacteriene și virale, Inspectoratul de Stat pentru controlul calității medicamentelor și echipamentelor medicale.
Pregătește documentația și standardele de standardizare și tehnică, desfășoară serviciul de standardizare în sistemul M3 al organizațiilor șefului URSS (GOS) și de bază (BOS) pentru standardizare, institute de cercetare care îndeplinesc sarcini de standardizare și departamente de standardizare și metrologie a stațiilor sanitare și epidemiologice; seful si organizarea de baza a serviciului de sanatate metrologica (vezi Serviciul de sanatate metrologica).
Bibliografie: Babayan E. A. și Utkin O. B. Dispoziții de bază pentru aprobarea medicamentelor în URSS și țări străine, M., 1982; Sistemul de stat de standardizare, M., 1975; Farmacopeea de Stat a Uniunii Republicilor Sovietice Socialiste, M., 1968; Comitetul de experți al OMS pentru specificații pentru produse farmaceutice, Ser. tehnologie. raport nr. 645, Geneva, 1981; International Pharmacopeia, vol. 1-2, Geneva, 1981; Ghid metodologic pentru evaluarea de laborator a calității preparatelor bacteriene și virale, ed. S. G. Dzagurova și alții, p. 5, M., 1972; Clasificator All-Union, Produse industriale și agricole, Grupe de clasificare superioară, M., 1977; Bazele legislaţiei URSS şi ale republicilor unionale despre îngrijirea sănătăţii, M., 1970; Sistemul standardelor de securitate a muncii, M., 1978; Sklyarov A. M. și Serebryany L. A. Cerințe ale sistemului de standarde de siguranță a muncii și locul lor în documentația de reglementare și tehnică, Gig. munca si prof. ill., nr. 12, p. 1, 1979; Standarde, tulpini și metode de control al preparatelor bacteriene și virale, ed. S. G. Dzagurova şi colab., M., 1979; Sumarokov A. A. Analiza fundamentelor științifice și metodologice ale standardizării vaccinurilor pe modelul colerogen-anatoxinei, Zh. micr., epid. și imuno., nr. I, p. 32, 1975; Sumarokov A.A., Salmin L.V. și Khlyabich G.N. Evaluarea epidemiologică a sistemului de indicatori care caracterizează calitatea preparatelor vaccinale, ibid., nr. 7, p. 78; Utyamyshev R. I. și Grishin A. N. Perspective pentru dezvoltarea unui sistem integrat de management al calității pentru echipamentele medicale din sectorul sănătății, Standarde și calitate, nr. 1, p. 43, 1983.
E. A. Babayan, M. Ya. Kaabak, V. Ya. Maksimov; S. G. Dzagurov, A. A. Sumarokov (imm.), Yu. F. Krylov, V. D. Kucherenko (fermă), L. A. Potanina, L. A. Serebryany (gig.).
Introducere
Produse medicamentoase (MP) - substanțe sau un amestec de substanțe de origine naturală sau sintetică, care sunt utilizate pentru tratamentul, prevenirea și diagnosticarea bolilor. Substanțele otrăvitoare și puternice (arsen, mercur, stupefiante și substanțe psihotrope) sunt adesea folosite ca medicamente, care, dacă sunt supradozate, pot duce la otrăviri severe și chiar la moarte. Printre medicamente, există chiar și forme de dozare care sunt potențial periculoase pentru sănătate, în special, injecțiile, în care chiar și substanțele inofensive devin periculoase (incluziuni mecanice), cu probleme de pirogenitate și sterilitate complet nerezolvate. Această specificitate impune cerințe stricte privind standardizarea și metodele de control al calității medicamentelor, care ar trebui să garanteze siguranța și acțiunea farmacologică a acestora. În acest sens, precum și cu tradițiile stabilite, standardizarea și controlul calității medicamentelor în toate țările sunt de obicei efectuate de o structură de stat independentă separată.
Principii generale ale sistemului de standardizare a medicamentelor
Standardizarea medicamentelor- elaborarea și aplicarea cerințelor și metodelor unificate pentru studiul formelor de dozare (standarde).
Standard de calitate LS- un document de reglementare care conține o listă de indicatori și metode normalizate pentru controlul calității medicamentelor, aprobat de Ministerul Sănătății al Federației Ruse (Ministerul Sănătății al Rusiei).
Sistemul de standardizare ar trebui să impună astfel de cerințe pentru dezvoltarea, studiile clinice, producția și vânzarea de medicamente care să asigure siguranța lor maximă, acțiunea farmacologică necesară și calitatea garantată în toate etapele utilizării lor.
În general, astfel de cerințe se reflectă cel mai pe deplin în cerințele GLP (Bună practică de laborator), GCP (Bună practică clinică) și GMP (Bună practică de fabricație), care sunt cazuri speciale ale standardelor internaționale ISO 9000 și reglementează studiile preclinice și clinice, producerea si comercializarea medicamentelor. Rețineți că USP XXIII conține și cerințe GMP pentru medicamente. În prezent, cerințele GMP interne au fost pregătite în Ucraina.
Trecerea la cerințele GLP, GCP și GMP necesită o cultură de producție destul de ridicată și costuri ridicate ale materialelor. În acele țări în care, din anumite motive, condițiile pentru o tranziție completă la aceste cerințe nu au fost încă formate, elementele lor principale sunt utilizate la crearea unui sistem de standardizare a medicamentelor.
Principii de bază ale standardizării medicamentelor:
1. Pot fi vândute numai acele medicamente care sunt aprobate pentru uz medical și vânzare într-o anumită țară.
certificare de standardizare a medicamentelor
2. Pot fi vândute numai acele medicamente pentru care există o documentație analitică de reglementare și tehnică (NTD) aprobată sau agreată de organismul de stat relevant.
3. NTD ar trebui să asigure un control obiectiv al calității medicamentelor obținute folosind această tehnologie. În cazul general, un anumit NTD poate asigura un control obiectiv al unui medicament obținut doar printr-o anumită tehnologie.
4. Nivelul producției ar trebui să asigure posibilitatea obținerii de medicamente cu indicatori de calitate prevăzuți în DNT.
5. Sistemul de control al calității pentru medicamentele vândute ar trebui să ofere posibilitatea depistarii defectelor.
Alineatul 3 înseamnă că, în general, una și aceeași NTD nu poate controla medicamentele obținute folosind tehnologii diferite. De exemplu, într-o schemă tehnologică de obținere a substanței paracetamol, nu sunt utilizați solvenți organici, prin urmare, în NTD dezvoltat pentru această tehnologie, aceștia nu sunt controlați. Dacă se dezvoltă o nouă tehnologie pentru producerea paracetamolului, care folosește, de exemplu, benzen, atunci este evident că calitatea acestuia nu poate fi controlată conform DNT anterioară. Este necesar să se introducă suplimentar controlul cantităților reziduale de benzen. O situație similară apare cu controlul impurităților tehnologice, care pot fi semnificativ diferite pentru diferite tehnologii. Prin urmare, actualul NTD, în general, poate controla doar tehnologia pe baza căreia a fost dezvoltat. Orice modificare a tehnologiei poate necesita ajustarea cerințelor NTD.
Din păcate, cerințele paragrafului 3 sunt deseori înțelese greșit și subestimate. O situație tipică: a fost importată în Ucraina o substanță importată (paracetamol), a cărei tehnologie de producție nu era cunoscută, a fost controlată conform actualului NTD și, pe baza acesteia, s-a făcut o concluzie despre calitatea acestei substanțe. Evident, acest lucru nu este suficient. Deoarece tehnologia este necunoscută, atunci solvenții reziduali, impuritățile de proces sunt necunoscute, care ar putea să nu fie controlate de NTD de mai sus. Dacă este necesar să se importe această substanță, atunci ar trebui efectuate studii suplimentare (în primul rând cromatografice). Situația este similară cu medicamentele gata preparate.
Punctul 4 înseamnă că nu orice companie farmaceutică poate produce acest medicament. De exemplu, producția de injecții necesită cerințe speciale pentru curățenie, echipament și personal. În caz contrar, este practic imposibil să obțineți un medicament de calitate.
Punctul 5 caracterizează relația dintre producători și consumatori. Sistemul de control al calității trebuie să asigure că producătorii mențin un nivel adecvat de producție, respectă cerințele documentației și reglementărilor științifice și tehnice, precum și posibilitatea de a detecta defectele accidentale și falsificarea. Acesta din urmă este deosebit de important pentru medicamentele puternice și vitale.






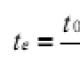



Doar îndrăgostiții vor supraviețui
Caracteristici ale reclamei destinate copiilor
retuşarea fotografiilor vechi în photoshop retuşarea fotografiilor vechi
Ce este un NPO: decodare, definirea scopurilor, tipuri de activități Are o organizație non-profit dreptul
Prim-adjunct Gleb Nikitin