Տարրի էլեկտրոնային բանաձևը կազմելու ալգորիթմ.
1. Որոշե՛ք ատոմի էլեկտրոնների թիվը՝ օգտագործելով քիմիական տարրերի պարբերական աղյուսակը D.I. Մենդելեևը.
2. Տարրը գտնվելու ժամանակաշրջանի քանակով որոշեք էներգիայի մակարդակների քանակը. վերջին էլեկտրոնային մակարդակում էլեկտրոնների թիվը համապատասխանում է խմբի համարին:
3. Մակարդակները բաժանել ենթամակարդակների և ուղեծրերի և լրացնել դրանք էլեկտրոններով՝ համաձայն ուղեծրերի լրացման կանոնների.
Պետք է հիշել, որ առաջին մակարդակն ունի առավելագույնը 2 էլեկտրոն: 1s2, երկրորդում՝ առավելագույնը 8 (երկու սև վեց R: 2s 2 2p 6), երրորդում՝ առավելագույնը 18 (երկու ս, վեց էջ, և տասը դ՝ 3s 2 3p 6 3d 10).
- Հիմնական քվանտային թիվը nպետք է լինի նվազագույն:
- Լրացված առաջին s-ենթամակարդակ, ապա p-, d-b f-ենթամակարդակներ.
- Էլեկտրոնները լրացնում են ուղեծրերը ուղեծրային էներգիայի աճման կարգով (Կլեչկովսկու կանոն)։
- Ենթամակարդակի ներսում էլեկտրոնները սկզբում մեկ առ մեկ գրավում են ազատ ուղեծրերը, և միայն դրանից հետո նրանք կազմում են զույգեր (Հունդի կանոն)։
- Մեկ ուղեծրում չի կարող լինել ավելի քան երկու էլեկտրոն (Պաուլիի սկզբունք):
Օրինակներ.
1. Կազմե՛ք ազոտի էլեկտրոնային բանաձեւը. Պարբերական աղյուսակում ազոտը 7-րդն է։

2. Կազմե՛ք արգոնի էլեկտրոնային բանաձեւը. Պարբերական աղյուսակում արգոնը 18-րդ տեղում է։
1s 2 2s 2 2p 6 3s 2 3p 6.

3. Կազմե՛ք քրոմի էլեկտրոնային բանաձեւը. Պարբերական աղյուսակում քրոմը 24-րդն է։
1 վ 2 2 վրկ 2 2p 6 3 վրկ 2 3p 6 4 վրկ 1 3d 5

Ցինկի էներգետիկ դիագրամ.
4. Կազմե՛ք ցինկի էլեկտրոնային բանաձեւը. Պարբերական աղյուսակում ցինկը 30-րդն է։
1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10
Նկատի ունեցեք, որ էլեկտրոնային բանաձևի մի մասը, այն է՝ 1s 2 2s 2 2p 6 3s 2 3p 6, արգոնի էլեկտրոնային բանաձևն է:
Ցինկի էլեկտրոնային բանաձևը կարող է ներկայացվել հետևյալ կերպ.
2. Ատոմների միջուկների և էլեկտրոնային թաղանթների կառուցվածքը
2.7. Էլեկտրոնների բաշխումը ատոմում
Ատոմում էլեկտրոնների վիճակը նշվում է հատուկ նշումով: Օրինակ, հելիումի ատոմի համար մենք ունենք.
Էլեկտրոնների բաշխումը ատոմում նշվում է հետևյալով.
ա) էլեկտրոնային սխեմաներ, որում նշվում է միայն յուրաքանչյուր շերտի էլեկտրոնների թիվը։ Օրինակ՝ Mg 2e , 8e , 2e ; Cl2e, 8e, 7e.
Հաճախ օգտագործվող գրաֆիկա էլեկտրոնային սխեմաներօրինակ՝ քլորի ատոմի համար.

բ) էլեկտրոնային կոնֆիգուրացիաներ; այս դեպքում ցուցադրվում են շերտի (մակարդակի) թիվը, ենթամակարդակների բնույթը և դրանց վրա գտնվող էլեկտրոնների քանակը։ Օրինակ:
Mg 1s 2 2s 2 2p 6 3s 2;
մեջ) էլեկտրոնային գրաֆիկական սխեմաներ, որոնց վրա պատկերված են ուղեծրեր, օրինակ՝ բջջի տեսքով, իսկ էլեկտրոնները պատկերված են սլաքներով (նկ. 2.6):

Բրինձ. 2.6. Էլեկտրոնային գրաֆիկական սխեման մագնեզիումի ատոմի համար
Էլեկտրոնային կոնֆիգուրացիաների ամբողջական բանաձևերից բացի, լայնորեն օգտագործվում են կրճատվածները: Այս դեպքում էլեկտրոնային կոնֆիգուրացիայի ազնիվ գազի բաժինը նշվում է ազնիվ գազի խորհրդանիշով քառակուսի փակագծերում: Օրինակ՝ 12 Mg3s 2, 19 K4s 1:
Կան որոշակի սկզբունքներ և կանոններ էներգիայի մակարդակները և ենթամակարդակները էլեկտրոններով լրացնելու համար.
1. Ատոմի նվազագույն ընդհանուր էներգիայի սկզբունքը, ըստ որի AO-ի պոպուլյացիան էլեկտրոններով տեղի է ունենում այնպես, որ ատոմի ընդհանուր էներգիան նվազագույն է։ Փորձնականորեն հաստատվել է AO լցման հետևյալ հաջորդականությունը.
1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p ... .
2. Մեկ AO-ն կարող է պարունակել ոչ ավելի, քան երկու էլեկտրոն, և այս դեպքում դրանց սպինները պետք է լինեն հակազուգահեռ:
3. Տրված էներգիայի ենթամակարդակի շրջանակներում էլեկտրոնները լրացնում են AO-ն աստիճանաբար, սկզբում մեկ-մեկ (նախ բոլոր թափուրները, իսկ հետո միայն երկու), և բոլոր չզույգված էլեկտրոնների կողմնորոշումը պետք է լինի նույնը, այսինքն. այդպիսին
բայց ոչ այդպես
Գրեթե ցանկացած ատոմում միայն s - և p -AO են արտաքին (նկ. 2.7), հետևաբար Ցանկացած ատոմի արտաքին էլեկտրոնային շերտը չի կարող ունենալ ավելի քան ութ էլեկտրոն:. Արտաքին էլեկտրոնային շերտը, որը պարունակում է ութ էլեկտրոն (հելիումի դեպքում երկուսը) կոչվում է ամբողջական։

Բրինձ. 2.7. K (a) և S (b) ատոմների էլեկտրոնային գրաֆիկական սխեմաներ.
Պարբերական համակարգի 4-րդ շրջանի տարրերի ատոմների էլեկտրոնային կոնֆիգուրացիաներըՏարբեր ատոմների էներգիայի տարբեր ենթամակարդակների էներգիայի արժեքները հաստատուն չեն, բայց կախված են տարրի ատոմի Z միջուկի լիցքից՝ Z = 1–20 Е 3 d > E 4 s և Е 3 ունեցող տարրերի համար d > E 4 p ; Z ≥ 21 ունեցող տարրերի ատոմների համար հակառակը՝ E 3 դ< E 4 s и Е 3 d < E 4 p (рис. 2.8). Кроме того, чем больше Z , тем меньше различаются подуровни по энергии, а кривые, выражающие зависимость энергии подуровней от Z , пересекаются.

Բրինձ. 2.8. Z = 1–20 (ա), Z ≥ 21 (բ) ունեցող տարրերի ատոմների էներգիայի ենթամակարդակների դիագրամ:
K և Ca ատոմների (հիմնական վիճակ) էլեկտրոնային կոնֆիգուրացիաները հետևյալն են (տես նկ. 2.8).
19 K՝ 1s 2 2s 2 2p 6 3s 2 3p 6 4s 1,
20 Ca՝ 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2:
Սկսած սկանդիումից (Z = 21) 3d ենթամակարդակը լցվում է, իսկ 4s էլեկտրոնները մնում են արտաքին շերտում։ Sc-ից Zn տարրերի ատոմների ընդհանուր էլեկտրոնային բանաձևը 3d 1−10 4s 1−2 է։ Օրինակ:
21 Sc: 3d 1 4s 2,
25 րոպե: 3d 5 4s 2,
28 Ni: 3d 8 4s 2:
30 Zn՝ 3d 10 4s 2:
Քրոմի և պղնձի համար նկատվում է 4s էլեկտրոնի սահում (խափանում) դեպի 3d ենթամակարդակ՝ Cr - 3d 5 4s 1, Cu - 3d 10 4s 1։ Նման ցատկ ns-ից դեպի (n - 1)d -ենթամակարդակ դիտվում է նաև այլ տարրերի ատոմներում (Mo, Ag, Au, Pt) և բացատրվում է ns- և (n) էներգիաների մոտիկությամբ։ - 1)d -ենթամակարդակները, ինչպես նաև կիսով չափ և ամբողջությամբ լցված d-ենթամակարդակների կայունությունը:
Հետագայում 10 դ-տարրերից հետո 4-րդ շրջանում հաջորդում են Ga (3d 10 4s 2 4p 1) մինչև Kr (3d 10 4s 2 4p 6) p-տարրերը:
D-տարրերի կատիոնների առաջացումը կապված է սկզբում արտաքին ns-, ապա (n - 1)d-էլեկտրոնների կորստի հետ, օրինակ.
Ti՝ 3d 2 4s 2 → − 2 e − Ti 2+ : 3d 2 → − 1 e − Ti 3+ : 3d 1
Mn՝ 3d 5 4s 2 → − 2 e − Mn 2+ : 3d 5 → − 2 e − Mn 4+ : 3d 3
Նկատի ունեցեք, որ էլեկտրոնային կոնֆիգուրացիաների բանաձևերում ընդունված է նախ գրել n-ի ավելի ցածր արժեք ունեցող բոլոր էլեկտրոնները, այնուհետև անցնել հիմնական քվանտային թվի ավելի մեծ արժեք ունեցող էլեկտրոնների նշմանը: Հետևաբար, 3d տարրերի լրացման և էներգիայի ենթամակարդակների գրանցման կարգը չեն համընկնում: Օրինակ, սկանդիումի ատոմի էլեկտրոնային բանաձեւում 3d ուղեծրը նշված է 4s ուղեծրից առաջ, թեեւ 4s ուղեծրը լրացված է ավելի վաղ։
Բնական հարց է ծագում՝ ինչո՞ւ է 4s ենթամակարդակը ավելի վաղ լցված 3d տարրերի ատոմներում, թեև դրա էներգիան ավելի մեծ է, քան 3d ենթամակարդակի էներգիան։ Ինչո՞ւ, օրինակ, Sc ատոմը հիմնական վիճակում չունի 1s 2 2s 2 2p 6 3s 2 3p 6 3d 3 էլեկտրոնային կոնֆիգուրացիան:
Դա պայմանավորված է նրանով, որ ատոմի տարբեր էլեկտրոնային վիճակների էներգիաների հարաբերակցությունը միշտ չէ, որ համընկնում է առանձին էներգետիկ ենթամակարդակների էներգիաների հարաբերակցության հետ: 4s ենթամակարդակի էներգիան 3d տարրերի համար ավելի մեծ է, քան 3d ենթամակարդակի էներգիան, բայց վիճակի էներգիան.
3d 1 4s 2-ը փոքր է 3d 3 վիճակի էներգիայից:
Սա բացատրվում է նրանով, որ միջէլեկտրոնային հակահարվածը և, համապատասխանաբար, ամբողջ վիճակի էներգիան կազմաձևման համար ... 3d 3 (երեք էլեկտրոններով նույն էներգիայի ենթամակարդակի վրա) ավելի մեծ է, քան կոնֆիգուրացիայի համար ... 3d 1 4s 2 (երեք էլեկտրոններով, էներգիայի տարբեր մակարդակներում):
Այն գրված է այսպես կոչված էլեկտրոնային բանաձեւերի տեսքով։ Էլեկտրոնային բանաձևերում s, p, d, f տառերը նշանակում են էլեկտրոնների էներգիայի ենթամակարդակները; տառերի դիմացի թվերը ցույց են տալիս էներգիայի մակարդակը, որում գտնվում է տվյալ էլեկտրոնը, իսկ վերևի աջ մասի ցուցիչը այս ենթամակարդակի էլեկտրոնների քանակն է։ Ցանկացած տարրի ատոմի էլեկտրոնային բանաձևը կազմելու համար բավական է իմանալ այս տարրի թիվը պարբերական համակարգում և կատարել հիմնական դրույթները, որոնք կարգավորում են ատոմում էլեկտրոնների բաշխումը:
 Ատոմի էլեկտրոնային թաղանթի կառուցվածքը կարելի է պատկերել նաև էներգետիկ բջիջներում էլեկտրոնների դասավորության տեսքով։
Ատոմի էլեկտրոնային թաղանթի կառուցվածքը կարելի է պատկերել նաև էներգետիկ բջիջներում էլեկտրոնների դասավորության տեսքով։
Երկաթի ատոմների համար նման սխեման ունի հետևյալ ձևը.
Այս դիագրամը հստակ ցույց է տալիս Հունդի կանոնի իրականացումը։ 3d ենթամակարդակի վրա առավելագույն գումար, բջիջները (չորս) լցված են չզույգված էլեկտրոններով։ Էլեկտրոնային թաղանթի կառուցվածքի պատկերը ատոմում էլեկտրոնային բանաձևերի և դիագրամների տեսքով հստակորեն չի արտացոլում էլեկտրոնի ալիքային հատկությունները։
Փոփոխված պարբերական օրենքի ձևակերպումըԱՅՈ։ Մենդելեևը : Պարզ մարմինների հատկությունները, ինչպես նաև տարրերի միացությունների ձևերն ու հատկությունները պարբերական կախվածության մեջ են տարրերի ատոմային կշիռների մեծությունից։
Պարբերական օրենքի ժամանակակից ձևակերպումՏարրերի հատկությունները, ինչպես նաև դրանց միացությունների ձևերն ու հատկությունները պարբերական կախվածության մեջ են իրենց ատոմների միջուկի լիցքի մեծությունից:
Այսպիսով, միջուկի դրական լիցքը (ոչ թե ատոմային զանգվածը) պարզվեց, որ ավելի ճշգրիտ փաստարկ է, որից կախված են տարրերի և դրանց միացությունների հատկությունները։
Վալանս- քիմիական կապերի քանակն է, որով մի ատոմ կապվում է մյուսին:
Ատոմի վալենտային հնարավորությունները որոշվում են չզույգված էլեկտրոնների քանակով և արտաքին մակարդակում ազատ ատոմային ուղեծրերի առկայությամբ։ Քիմիական տարրերի ատոմների արտաքին էներգիայի մակարդակների կառուցվածքը որոշում է հիմնականում դրանց ատոմների հատկությունները։ Հետեւաբար, այս մակարդակները կոչվում են վալենտական մակարդակներ: Այս մակարդակների, իսկ երբեմն էլ մինչարտաքին մակարդակների էլեկտրոնները կարող են մասնակցել քիմիական կապերի ձևավորմանը։ Նման էլեկտրոնները կոչվում են նաև վալենտային էլեկտրոններ։
Ստոյխիոմետրիկ վալենտությունքիմիական տարր - համարժեքների քանակն է, որը տվյալ ատոմը կարող է կցել ինքն իրեն, կամ ատոմի համարժեքների թիվն է։
Համարժեքները որոշվում են կցված կամ փոխարինված ջրածնի ատոմների քանակով, հետևաբար ստոյխիոմետրիկ վալենտությունը հավասար է ջրածնի ատոմների թվին, որոնց հետ փոխազդում է այս ատոմը։ Բայց ոչ բոլոր տարրերն են ազատորեն փոխազդում, բայց գրեթե ամեն ինչ փոխազդում է թթվածնի հետ, ուստի ստոյխիոմետրիկ վալենտությունը կարող է սահմանվել որպես կցված թթվածնի ատոմների թվի կրկնապատիկ:
Օրինակ, ծծմբի ստոյխիոմետրիկ վալենտությունը ջրածնի սուլֆիդում H 2 S է 2, SO 2 - 4 օքսիդում, SO 3 -6 օքսիդում:
Երկուական միացության բանաձևով տարրի ստոյխիոմետրիկ վալենտականությունը որոշելիս պետք է առաջնորդվել կանոնով. մի տարրի բոլոր ատոմների ընդհանուր վալենտականությունը պետք է հավասար լինի մեկ այլ տարրի բոլոր ատոմների ընդհանուր վալենտությանը:
Օքսիդացման վիճակնույնպես բնութագրում է նյութի բաղադրությունը և հավասար է ստոյխիոմետրիկ վալենտին գումարած նշանով (մոլեկուլում մետաղի կամ ավելի էլեկտրադրական տարրի համար) կամ մինուս։
1. Պարզ նյութերում տարրերի օքսիդացման աստիճանը զրո է։
2. Բոլոր միացություններում ֆտորի օքսիդացման աստիճանը -1 է։ Մնացած հալոգենները (քլոր, բրոմ, յոդ) մետաղների, ջրածնի և այլ ավելի էլեկտրադրական տարրերի հետ նույնպես ունեն -1 օքսիդացման աստիճան, բայց ավելի էլեկտրաբացասական տարրեր ունեցող միացություններում նրանք ունեն դրական օքսիդացման վիճակներ։
3. Միացություններում թթվածինը ունի -2 օքսիդացման աստիճան; Բացառություն են կազմում ջրածնի պերօքսիդ H 2 O 2 և նրա ածանցյալները (Na 2 O 2, BaO 2 և այլն, որոնցում թթվածինն ունի -1 օքսիդացման աստիճան, ինչպես նաև թթվածնի ֆտորիդը 2, որում թթվածնի օքսիդացման աստիճանը +2 է։
4. Ալկալային տարրերը (Li, Na, K և այլն) և Պարբերական համակարգի երկրորդ խմբի հիմնական ենթախմբի տարրերը (Be, Mg, Ca և այլն) միշտ ունեն խմբի թվին հավասար օքսիդացման աստիճան, որ. համապատասխանաբար +1 և +2 է:
5. Երրորդ խմբի բոլոր տարրերը, բացառությամբ թալիումի, ունեն հաստատուն օքսիդացման վիճակ, որը հավասար է խմբի թվին, այսինքն. +3.
6. Տարրի ամենաբարձր օքսիդացման աստիճանը հավասար է Պարբերական համակարգի խմբի թվին, իսկ ամենացածրը տարբերությունն է՝ խմբի թիվը՝ 8։ Օրինակ. բարձրագույն աստիճանազոտի օքսիդացումը (այն գտնվում է հինգերորդ խմբում) +5 է (ազոտական թթվի և նրա աղերի մեջ), իսկ ամենացածրը՝ -3 (ամոնիակի և ամոնիումի աղերում)։
7. Միացության տարրերի օքսիդացման վիճակները փոխզիջում են միմյանց այնպես, որ մոլեկուլի կամ չեզոք բանաձևի միավորի բոլոր ատոմների գումարը զրո է, իսկ իոնի համար՝ նրա լիցքը։
Այս կանոնները կարող են օգտագործվել միացության մեջ տարրի անհայտ օքսիդացման վիճակը որոշելու համար, եթե մնացածի օքսիդացման վիճակները հայտնի են, և բազմատարր միացություններ ձևակերպելու համար։
Օքսիդացման աստիճանը (օքսիդացման համարը,) — Օժանդակ պայմանական արժեք՝ օքսիդացման, վերականգնողական և ռեդոքսային ռեակցիաների գործընթացները գրանցելու համար։
հայեցակարգ օքսիդացման վիճակհաճախ օգտագործվում է անօրգանական քիմիայում՝ հայեցակարգի փոխարեն վալենտություն. Ատոմի օքսիդացման աստիճանը հավասար է ատոմին վերագրվող էլեկտրական լիցքի թվային արժեքին, ենթադրելով, որ կապն իրականացնող էլեկտրոնային զույգերը լիովին կողմնակալ են դեպի ավելի էլեկտրաբացասական ատոմներ (այսինքն՝ հիմնվելով այն ենթադրության վրա, որ միացությունը բաղկացած է. միայն իոններից):
Օքսիդացման վիճակը համապատասխանում է էլեկտրոնների քանակին, որոնք պետք է ավելացվեն դրական իոնին՝ այն չեզոք ատոմի վերածելու համար, կամ վերցվեն բացասական իոնից՝ այն չեզոք ատոմի օքսիդացնելու համար.
Al 3+ + 3e − → Al
S 2− → S + 2e − (S 2− − 2e − → S)
Տարրերի հատկությունները, կախված ատոմի էլեկտրոնային թաղանթի կառուցվածքից, փոխվում են ըստ պարբերական համակարգի ժամանակաշրջանների և խմբերի։ Քանի որ մի շարք անալոգային տարրերի էլեկտրոնային կառուցվածքները միայն նման են, բայց ոչ նույնական, ապա խմբի մի տարրից մյուսը տեղափոխվելիս նրանց համար նկատվում է ոչ թե հատկությունների պարզ կրկնություն, այլ դրանց քիչ թե շատ հստակ արտահայտված կանոնավոր փոփոխություն:
Տարրի քիմիական բնույթը որոշվում է նրա ատոմի՝ էլեկտրոններ կորցնելու կամ ստանալու ունակությամբ։ Այս ունակությունը չափվում է իոնացման էներգիաների և էլեկտրոնների մերձեցման արժեքներով:
Իոնացման էներգիա (Ei) էներգիայի նվազագույն քանակն է, որն անհրաժեշտ է գազային փուլում ատոմից էլեկտրոնի անջատման և ամբողջական հեռացման համար T = 0:
K առանց արձակված էլեկտրոնի կինետիկ էներգիան փոխանցելու ատոմը դրական լիցքավորված իոնի վերածելով՝ E + Ei = E + + e-: Իոնացման էներգիան դրական արժեք է և ունի ամենացածր արժեքները ալկալային մետաղների ատոմների և ամենաբարձրը ազնիվ (իներտ) գազի ատոմների համար:
Էլեկտրոնների մերձեցում (Ee) Այն էներգիան է, որն ազատվում կամ կլանվում է, երբ էլեկտրոնը կցվում է ատոմին գազային փուլում T = 0
K-ն ատոմի վերածելով բացասական լիցքավորված իոնի՝ առանց մասնիկին կինետիկ էներգիա փոխանցելու.
E + e- = E- + Ee.
Հալոգենները, հատկապես ֆտորը, ունեն առավելագույն էլեկտրոնային կապ (Ee = -328 կՋ/մոլ):
Ei-ի և Ee-ի արժեքներն արտահայտվում են կիլոջոուլներով մեկ մոլում (կՋ/մոլ) կամ մեկ ատոմի համար էլեկտրոն վոլտներով (eV):
Կապված ատոմի կարողությունը քիմիական կապերի էլեկտրոնները դեպի իրեն տեղափոխելու՝ իր շուրջը էլեկտրոնի խտությունը մեծացնելով կոչվում է. էլեկտրաբացասականություն.
Այս հասկացությունը գիտության մեջ մտցրեց Լ.Պոլինգը։ Էլեկտրոնեգատիվություննշվում է ÷ նշանով և բնութագրում է տվյալ ատոմի էլեկտրոնները միացնելու միտումը, երբ այն ստեղծում է քիմիական կապ։
Ըստ Ռ.Մալիքենի, ատոմի էլեկտրաբացասականությունը գնահատվում է h = (Ee + Ei)/2 իոնացման էներգիաների գումարի և ազատ ատոմների էլեկտրոնային մերձավորության կեսով:
Ժամանակաշրջաններում իոնացման էներգիայի և էլեկտրաբացասականության ընդհանուր միտում կա ատոմային միջուկի լիցքի ավելացման հետ, խմբերում այդ արժեքները նվազում են տարրի հերթական թվի աճով:
Հարկ է ընդգծել, որ տարրին չի կարելի վերագրել էլեկտրաբացասականության հաստատուն արժեք, քանի որ դա կախված է բազմաթիվ գործոններից, մասնավորապես՝ տարրի վալենտային վիճակից, միացության տեսակից, որտեղ այն մտնում է, հարևան ատոմների քանակից և տեսակից։ .
Ատոմային և իոնային շառավիղներ. Ատոմների և իոնների չափերը որոշվում են էլեկտրոնային թաղանթի չափսերով։ Համաձայն քվանտային մեխանիկական հասկացությունների՝ էլեկտրոնային թաղանթը չունի խիստ սահմանված սահմաններ։ Հետեւաբար, ազատ ատոմի կամ իոնի շառավիղի համար մենք կարող ենք վերցնել տեսականորեն հաշվարկված հեռավորությունը միջուկից մինչև արտաքին էլեկտրոնային ամպերի հիմնական առավելագույն խտության դիրքը:Այս հեռավորությունը կոչվում է ուղեծրի շառավիղ: Գործնականում սովորաբար օգտագործվում են միացություններում ատոմների և իոնների շառավիղների արժեքները, որոնք հաշվարկվում են փորձարարական տվյալների հիման վրա: Այս դեպքում առանձնանում են ատոմների կովալենտային և մետաղական շառավիղները։
Ատոմային և իոնային շառավիղների կախվածությունը տարրի ատոմի միջուկի լիցքից և պարբերական է. Ժամանակահատվածներում, երբ ատոմային թիվը մեծանում է, շառավիղները հակված են նվազելու: Ամենամեծ նվազումը բնորոշ է փոքր ժամանակաշրջանների տարրերին, քանի որ դրանցում լրացվում է արտաքին էլեկտրոնային մակարդակը։ d- և f-տարրերի ընտանիքներում մեծ ժամանակաշրջաններում այս փոփոխությունը ավելի քիչ կտրուկ է, քանի որ դրանցում էլեկտրոնների լիցքավորումը տեղի է ունենում նախածավալ շերտում: Ենթախմբերում ընդհանուր առմամբ մեծանում են նույն տեսակի ատոմների և իոնների շառավիղները։
Տարրերի պարբերական համակարգը տարրերի հատկություններում տարբեր տեսակի պարբերականության դրսևորման հստակ օրինակ է, որը դիտվում է հորիզոնական (ձախից աջ ժամանակահատվածում), ուղղահայաց (խմբում, օրինակ, վերևից ներքև): ), անկյունագծով, այսինքն. ատոմի որոշ հատկություն մեծանում կամ նվազում է, բայց պարբերականությունը պահպանվում է։
Ձախից աջ ընկած ժամանակահատվածում (→) տարրերի օքսիդացնող և ոչ մետաղական հատկությունները մեծանում են, իսկ վերականգնող և մետաղական հատկությունները նվազում են։ Այսպիսով, 3-րդ շրջանի բոլոր տարրերից նատրիումը կլինի ամենաակտիվ մետաղը և ամենաուժեղ վերականգնող նյութը, իսկ քլորը կլինի ամենաուժեղ օքսիդացնողը:
քիմիական կապ- սա ատոմների փոխկապակցումն է մոլեկուլում կամ բյուրեղային ցանցում՝ ատոմների միջև ձգող էլեկտրական ուժերի գործողության արդյունքում:
Սա բոլոր էլեկտրոնների և բոլոր միջուկների փոխազդեցությունն է, որը հանգեցնում է կայուն, բազմատոմային համակարգի ձևավորմանը (արմատական, մոլեկուլային իոն, մոլեկուլ, բյուրեղ):
Քիմիական կապն իրականացվում է վալենտային էլեկտրոնների միջոցով։ Ժամանակակից հասկացությունների համաձայն՝ քիմիական կապն ունի էլեկտրոնային բնույթ, սակայն այն իրականացվում է տարբեր ձևերով։ Հետևաբար, գոյություն ունեն քիմիական կապերի երեք հիմնական տեսակ. կովալենտ, իոնային, մետաղականՄոլեկուլների միջև առաջանում է ջրածնային կապ,և պատահի վան դեր Վալսի փոխազդեցությունները.
Քիմիական կապի հիմնական բնութագրերն են.
- կապի երկարությունը - միջմիջուկային հեռավորությունն է քիմիապես կապված ատոմների միջև։
Դա կախված է փոխազդող ատոմների բնույթից և կապի բազմակիությունից։ Բազմապատկության աճով կապի երկարությունը նվազում է, և, հետևաբար, դրա ամրությունը մեծանում է.
- կապի բազմակիությունը - որոշվում է երկու ատոմ կապող էլեկտրոնային զույգերի քանակով: Քանի որ բազմակիությունը մեծանում է, կապող էներգիան մեծանում է.
- միացման անկյուն- երկու քիմիապես փոխկապակցված հարևան ատոմների միջուկներով անցնող երևակայական ուղիղ գծերի միջև անկյունը.
Պարտադիր էներգիա E CB - սա այն էներգիան է, որն ազատվում է այս կապի ձևավորման ժամանակ և ծախսվում է այն խզելու վրա, կՋ/մոլ:
կովալենտային կապ - Քիմիական կապ, որը ձևավորվում է երկու ատոմների հետ զույգ էլեկտրոնների համատեղմամբ:
Քիմիական կապի բացատրությունը ատոմների միջև ընդհանուր էլեկտրոնային զույգերի ի հայտ գալով հիմք է հանդիսացել վալենտության սպին տեսության, որի գործիքն է. վալենտային կապի մեթոդ (MVS) Լյուիսը հայտնաբերել է 1916 թվականին: Քիմիական կապի և մոլեկուլների կառուցվածքի քվանտային մեխանիկական նկարագրության համար օգտագործվում է մեկ այլ մեթոդ. մոլեկուլային ուղեծրային մեթոդ (MMO) .
Վալենտային կապի մեթոդ
Ըստ MVS-ի քիմիական կապի ձևավորման հիմնական սկզբունքները.
1. Քիմիական կապ է գոյանում վալենտային (չզույգված) էլեկտրոնների շնորհիվ։
2. Երկու տարբեր ատոմներին պատկանող հակազուգահեռ սպիններով էլեկտրոնները սովորական են դառնում։
3. Քիմիական կապ է գոյանում միայն այն դեպքում, երբ երկու կամ ավելի ատոմներ միմյանց մոտենալու դեպքում համակարգի ընդհանուր էներգիան նվազում է։
4. Մոլեկուլում գործող հիմնական ուժերը էլեկտրական, կուլոնյան ծագում ունեն։
5. Որքան ուժեղ է կապը, այնքան փոխազդող էլեկտրոնային ամպերը համընկնում են:
Կովալենտային կապի ձևավորման երկու մեխանիզմ կա.
փոխանակման մեխանիզմ:Կապը ձևավորվում է երկու չեզոք ատոմների վալենտային էլեկտրոնների համատեղմամբ: Յուրաքանչյուր ատոմ տալիս է մեկ չզույգված էլեկտրոն ընդհանուր էլեկտրոնային զույգին.
Բրինձ. 7. Կովալենտային կապի ձևավորման փոխանակման մեխանիզմ. ա- ոչ բևեռային; բ- բևեռային
Դոնոր-ընդունող մեխանիզմ.Մի ատոմ (դոնոր) ապահովում է էլեկտրոնային զույգ, իսկ մեկ այլ ատոմ (ընդունող) ապահովում է դատարկ ուղեծիր այս զույգի համար։
կապեր, կրթվածըստ դոնոր-ընդունող մեխանիզմի, պատկանում են բարդ միացություններ
 |
Բրինձ. 8. Կովալենտային կապի առաջացման դոնոր-ընդունիչ մեխանիզմ
Կովալենտային կապն ունի որոշակի բնութագրեր.
Հագեցվածություն - ատոմների հատկությունը՝ կազմելու խիստ սահմանված թվով կովալենտային կապեր։Կապերի հագեցվածության պատճառով մոլեկուլներն ունեն որոշակի բաղադրություն։
|
Կողմնորոշում - տ . ե) կապը ձևավորվում է էլեկտրոնային ամպերի առավելագույն համընկնման ուղղությամբ . Կապ ձևավորող ատոմների կենտրոնները միացնող գծի հետ կապված՝ σ և π (նկ. 9)՝ σ-կապ - ձևավորվում է փոխազդող ատոմների կենտրոնները միացնող գծի երկայնքով AO-ի համընկնումով. Π-կապը կապ է, որն առաջանում է ատոմի միջուկները միացնող ուղիղ գծին ուղղահայաց առանցքի ուղղությամբ։ Կապի կողմնորոշումը որոշում է մոլեկուլների տարածական կառուցվածքը, այսինքն՝ դրանց երկրաչափական ձևը։ հիբրիդացում - դա որոշ ուղեծրերի ձևի փոփոխություն է կովալենտային կապի ձևավորման մեջ՝ ուղեծրերի ավելի արդյունավետ համընկնման հասնելու համար:Հիբրիդային օրբիտալների էլեկտրոնների մասնակցությամբ առաջացած քիմիական կապն ավելի ամուր է, քան ոչ հիբրիդային s- և p-օրբիտալների էլեկտրոնների մասնակցությամբ կապը, քանի որ ավելի շատ համընկնում կա: Կան հիբրիդացման հետևյալ տեսակները (նկ. 10, աղյուսակ 31). |
sp 2 հիբրիդացում- մեկ s- ուղեծրը և երկու p-ուղիղները վերածվում են երեք նույնական «հիբրիդային» ուղեծրերի, որոնց առանցքների միջև անկյունը 120° է: Մոլեկուլները, որոնցում իրականացվում է sp 2 հիբրիդացում, ունեն հարթ երկրաչափություն (BF 3, AlCl 3):
sp 3-հիբրիդացում- մեկ s-օրբիտալը և երեք p-ուղիղները վերածվում են չորս նույնական «հիբրիդային» ուղեծրերի, որոնց առանցքների միջև անկյունը 109 ° 28» է: Մոլեկուլները, որոնցում տեղի է ունենում sp 3 հիբրիդացում, ունեն քառանիստ երկրաչափություն (CH 4 , NH3):



Բրինձ. 10. Վալենտային օրբիտալների հիբրիդացման տեսակները. a - sp-վալենտային օրբիտալների հիբրիդացում; բ - sp2-վալենտային օրբիտալների հիբրիդացում; մեջ - sp 3 - վալենտային ուղեծրերի հիբրիդացում
Ատոմների էլեկտրոնային թաղանթների կառուցվածքը կարևոր դեր է խաղում քիմիայում, որոշում նյութերի քիմիական հատկությունները։ Որոշակի ուղեծրում էլեկտրոնի շարժման ամենակարեւոր բնութագիրը միջուկի հետ նրա միացման էներգիան է։ Ատոմում էլեկտրոնները տարբերվում են որոշակի էներգիայով, և, ինչպես ցույց են տալիս փորձերը, ոմանք ավելի ուժեղ են ձգվում դեպի միջուկը, մյուսները՝ ավելի թույլ։ Դա բացատրվում է միջուկից էլեկտրոնների հեռավորությամբ։ Որքան մոտ են էլեկտրոնները միջուկին, այնքան մեծ է նրանց կապը միջուկի հետ, բայց այնքան քիչ էներգիա: Ատոմի միջուկից հեռավորության հետ էլեկտրոնի դեպի միջուկ ձգող ուժը նվազում է, իսկ էներգիայի մատակարարումը մեծանում է։ Այսպես են ձևավորվում էլեկտրոնային շերտերը ատոմի էլեկտրոնային թաղանթում։ Նմանատիպ էներգիայի արժեքներով էլեկտրոնները կազմում են մեկ էլեկտրոնային շերտ կամ էներգիայի մակարդակ: Ատոմում էլեկտրոնների էներգիան և էներգիայի մակարդակը որոշվում է հիմնական քվանտային թվով n և ընդունում է 1, 2, 3, 4, 5, 6 և 7 ամբողջ արժեքները: Որքան մեծ է n-ի արժեքը, այնքան մեծ է էներգիան: ատոմի էլեկտրոնի մասին: Էլեկտրոնների առավելագույն քանակը, որոնք կարող են լինել որոշակի էներգիայի մակարդակում, որոշվում է բանաձևով.
Որտեղ N-ը էլեկտրոնների առավելագույն քանակն է մեկ մակարդակում.
n-ը էներգիայի մակարդակի թիվն է:
Սահմանվել է, որ առաջին թաղանթի վրա գտնվում են ոչ ավելի, քան երկու էլեկտրոններ, երկրորդի վրա՝ ութից, երրորդում՝ 18-ից ոչ ավելի, չորրորդում՝ 32-ից ավելի: հեռավոր պատյաններ. Հայտնի է, որ արտաքին էներգիայի մակարդակը կարող է պարունակել ոչ ավելի, քան ութ էլեկտրոն, այն կոչվում է ամբողջական։ Էլեկտրոնային շերտերը, որոնք չեն պարունակում առավելագույն թվով էլեկտրոններ, կոչվում են թերի:
Ատոմի էլեկտրոնային թաղանթի արտաքին էներգիայի մակարդակում էլեկտրոնների թիվը հավասար է հիմնական ենթախմբերի քիմիական տարրերի խմբի համարին:
Ինչպես նախկինում նշվեց, էլեկտրոնը շարժվում է ոչ թե ուղեծրով, այլ ուղեծրով և չունի հետագիծ:
Միջուկի շուրջ տարածությունը, որտեղ ամենայն հավանականությամբ կլինի տվյալ էլեկտրոնը, կոչվում է այդ էլեկտրոնի ուղեծր կամ էլեկտրոնային ամպ:
Օրբիտալները կամ ենթամակարդակները, ինչպես նաև կոչվում են, կարող են ունենալ տարբեր ձևեր, և դրանց թիվը համապատասխանում է մակարդակի թվին, բայց չի գերազանցում չորսը։ Առաջին էներգետիկ մակարդակն ունի մեկ ենթամակարդակ (ներ), երկրորդը՝ երկու (s,p), երրորդը՝ երեք (s,p,d) և այլն։ Նույն մակարդակի տարբեր ենթամակարդակների էլեկտրոններն ունեն էլեկտրոնային ամպի տարբեր ձևեր՝ գնդաձև (ներ), համրաձև (p) և ավելի բարդ կոնֆիգուրացիաներ (d) և (f): Գիտնականները համաձայնել են գնդաձեւ ատոմային ուղեծիր անվանել ս- ուղեծրային. Այն ամենակայունն է և գտնվում է միջուկին բավականին մոտ։
Որքան մեծ է էլեկտրոնի էներգիան ատոմում, այնքան ավելի արագ է այն պտտվում, այնքան ավելի է երկարացվում նրա մնալու շրջանը և, վերջապես, այն վերածվում է համրաձևի։ էջ- ուղեծրային:
Այս ձևի էլեկտրոնային ամպը կարող է ատոմում երեք դիրք զբաղեցնել տիեզերքի կոորդինատային առանցքների երկայնքով x, yև զ. Սա հեշտությամբ բացատրվում է. ի վերջո, բոլոր էլեկտրոնները բացասական լիցքավորված են, ուստի էլեկտրոնային ամպերը վանում են միմյանց և հակված են հնարավորինս հեռու տեղակայվել միմյանցից:
Այսպիսով, էջԿարող են լինել երեք ուղեծրեր. Նրանց էներգիան, իհարկե, նույնն է, բայց նրանց դիրքը տարածության մեջ տարբեր է։
Գծե՛ք էներգիայի մակարդակների էլեկտրոններով հաջորդական լրացման դիագրամ
Այժմ մենք կարող ենք կազմել ատոմների էլեկտրոնային թաղանթների կառուցվածքի դիագրամ.
1. Որոշե՛ք թաղանթի վրա էլեկտրոնների ընդհանուր թիվը տարրի հերթական համարով:
2. Որոշեք էլեկտրոնային թաղանթի էներգիայի մակարդակների քանակը: Նրանց թիվը հավասար է Դ.Ի.Մենդելեևի աղյուսակի այն ժամանակաշրջանի թվին, որում գտնվում է տարրը:
3. Որոշեք էլեկտրոնների թիվը յուրաքանչյուր էներգետիկ մակարդակում:
4. Օգտագործելով արաբական թվեր մակարդակը նշանակելու և ուղեծրերը s և p տառերով և էլեկտրոնների քանակի նշանակման համար տվյալ ուղեծրում Արաբական համարըտառի վերևի աջ մասում մենք պատկերում ենք ատոմների կառուցվածքը ավելի ամբողջական էլեկտրոնային բանաձևերով: Գիտնականները համաձայնել են յուրաքանչյուր ատոմային ուղեծիր նշանակել որպես քվանտային բջիջ՝ քառակուսի էներգիայի դիագրամի վրա.
Վրա սԵնթամակարդակը կարող է պարունակել մեկ ատոմային ուղեծր
և շարունակ էջ- արդեն կարող է լինել երեք ենթամակարդակ.
(ըստ երեք կոորդինատային առանցքների).
Օրբիտալներ դ- և զ- Ատոմում ենթամակարդակներն արդեն կարող են լինել համապատասխանաբար հինգ և յոթ.
Ջրածնի ատոմի միջուկն ունի +1 լիցք, ուստի միայն մեկ էլեկտրոն է շարժվում իր միջուկի շուրջ մեկ էներգիայի մակարդակով։ Եկեք գրենք ջրածնի ատոմի էլեկտրոնային կոնֆիգուրացիան
Քիմիական տարրի ատոմի կառուցվածքի և նրա հատկությունների միջև կապ հաստատելու համար մենք կքննարկենք ևս մի քանի քիմիական տարրեր:
Ջրածնից հետո հաջորդ տարրը հելիումն է։ Հելիումի ատոմի միջուկն ունի +2 լիցք, ուստի հելիումի ատոմը պարունակում է երկու էլեկտրոն առաջին էներգետիկ մակարդակում.
Քանի որ առաջին էներգիայի մակարդակը կարող է պարունակել ոչ ավելի, քան երկու էլեկտրոն, այն համարվում է ամբողջական:
Տարր թիվ 3 - լիթիում: Լիթիումի միջուկն ունի +3 լիցք, հետևաբար, լիթիումի ատոմում կա երեք էլեկտրոն։ Նրանցից երկուսը գտնվում են առաջին էներգետիկ մակարդակում, իսկ երրորդ էլեկտրոնը սկսում է լրացնել երկրորդ էներգետիկ մակարդակը: Նախ լրացվում է առաջին մակարդակի s ուղեծրը, ապա երկրորդ մակարդակի s ուղեծրը։ Երկրորդ մակարդակի էլեկտրոնն ավելի թույլ է կապված միջուկի հետ, քան մյուս երկուսը:
Ածխածնի ատոմի համար մենք արդեն կարող ենք ենթադրել երեք հնարավոր սխեմաներԷլեկտրոնային թաղանթների լրացում էլեկտրոնային գրաֆիկական բանաձևերի համաձայն.
Ատոմային սպեկտրի վերլուծությունը ցույց է տալիս, որ վերջին սխեման ճիշտ է։ Օգտագործելով այս կանոնը, դժվար չէ ազոտի ատոմի էլեկտրոնային կառուցվածքի դիագրամ կազմել.
Այս սխեման համապատասխանում է 1s22s22p3 բանաձեւին: Այնուհետև սկսվում է էլեկտրոնների զույգ-զույգ տեղադրումը 2p օրբիտալներում։ Երկրորդ շրջանի մնացած ատոմների էլեկտրոնային բանաձևերը.
Ավարտվում է նեոնային ատոմի երկրորդ էներգետիկ մակարդակի լրացումը, և ավարտվում է տարրերի համակարգի երկրորդ շրջանի կառուցումը։
Պարբերական համակարգում գտե՛ք լիթիումի քիմիական նշանը՝ լիթիումից մինչև նեոնային Ne, ատոմային միջուկների լիցքը բնականաբար մեծանում է։ Երկրորդ շերտը աստիճանաբար լցվում է էլեկտրոններով։ Երկրորդ շերտում էլեկտրոնների քանակի ավելացմամբ տարրերի մետաղական հատկությունները աստիճանաբար թուլանում են և փոխարինվում են ոչ մետաղականներով։
Երրորդ շրջանը, ինչպես և երկրորդը, սկսվում է երկու տարրով (Na, Mg), որոնցում էլեկտրոնները գտնվում են արտաքին էլեկտրոնային շերտի s-ենթամակարդակի վրա։ Դրան հաջորդում են վեց տարրեր (Al-ից Ar), որոնցում ձևավորվում է արտաքին էլեկտրոնային շերտի p-ենթամակարդակը։ Երկրորդ և երրորդ շրջանների համապատասխան տարրերի արտաքին էլեկտրոնային շերտի կառուցվածքը նման է. Այլ կերպ ասած, միջուկի լիցքի ավելացման հետ մեկտեղ պարբերաբար կրկնվում է ատոմների արտաքին շերտերի էլեկտրոնային կառուցվածքը։ Եթե տարրերն ունեն նույնական արտաքին էներգիայի մակարդակներ, ապա այդ տարրերի հատկությունները նման են: Օրինակ՝ արգոնը և նեոնը արտաքին մակարդակում պարունակում են ութ էլեկտրոն, և, հետևաբար, դրանք իներտ են, այսինքն՝ գրեթե չեն մտնում քիմիական ռեակցիաների մեջ։ Ազատ ձևով արգոնը և նեոնը գազեր են, որոնք ունեն միատոմային մոլեկուլներ։
Լիթիումի, նատրիումի և կալիումի ատոմները արտաքին մակարդակում պարունակում են մեկ էլեկտրոն և ունեն նմանատիպ հատկություններ, ուստի դրանք դասավորված են պարբերական համակարգի նույն խմբում։
III. Եզրակացություններ.
1. Քիմիական տարրերի հատկությունները, որոնք դասավորված են միջուկի լիցքի աճման կարգով, պարբերաբար կրկնվում են, քանի որ տարրերի ատոմների արտաքին էներգիայի մակարդակների կառուցվածքը պարբերաբար կրկնվում է։
2. Մեկ ժամանակահատվածում քիմիական տարրերի հատկությունների սահուն փոփոխությունը կարելի է բացատրել արտաքին էներգիայի մակարդակում էլեկտրոնների քանակի աստիճանական աճով։
3. Նույն ընտանիքին պատկանող քիմիական տարրերի հատկությունների նմանության պատճառը նրանց ատոմների արտաքին էներգիայի մակարդակների նույն կառուցվածքում է։
Ատոմի էլեկտրոնային կառուցվածքը կարելի է ցույց տալ էլեկտրոնային բանաձևով և էլեկտրոնային գրաֆիկական դիագրամով։ Էլեկտրոնային բանաձևերում էներգիայի մակարդակները և ենթամակարդակները հաջորդաբար գրվում են ըստ դրանց լրացման և ենթամակարդակի էլեկտրոնների ընդհանուր քանակի: Այս դեպքում առանձին էլեկտրոնի վիճակը, մասնավորապես նրա մագնիսական և սպին քվանտային թվերը, չեն արտացոլվում էլեկտրոնային բանաձևում։ Էլեկտրոնային գրաֆիկական սխեմաներում յուրաքանչյուր էլեկտրոն ամբողջությամբ «տեսանելի է», այսինքն. այն կարելի է բնութագրել բոլոր չորս քվանտային թվերով։ Էլեկտրոնային գրաֆիկական դիագրամները սովորաբար տրվում են արտաքին էլեկտրոնների համար:
Օրինակ 1Գրե՛ք ֆտորի էլեկտրոնային բանաձևը, արտահայտե՛ք արտաքին էլեկտրոնների վիճակը էլեկտրոնային գրաֆիկական գծապատկերով։ Քանի՞ չզույգացված էլեկտրոն կա այս տարրի ատոմում:
Լուծում.Ֆտորի ատոմային թիվը ինը է, ուստի նրա ատոմում կա ինը էլեկտրոն։ Նվազագույն էներգիայի սկզբունքի համաձայն՝ օգտագործելով Նկ. 7 և հաշվի առնելով Պաուլիի սկզբունքի հետևանքները՝ գրում ենք ֆտորի էլեկտրոնային բանաձևը՝ 1s 2 2s 2 2p 5: Արտաքին էլեկտրոնների համար (երկրորդ էներգիայի մակարդակը) մենք կազմում ենք էլեկտրոնային գրաֆիկական սխեման (նկ. 8), որից հետևում է, որ ֆտորի ատոմում կա մեկ չզույգված էլեկտրոն։
Բրինձ. 8. Ֆտորի ատոմի վալենտային էլեկտրոնների էլեկտրոն-գրաֆիկական սխեման
Օրինակ 2Կազմե՛ք ազոտի ատոմի հնարավոր վիճակների էլեկտրոնային գրաֆիկական դիագրամներ: Դրանցից ո՞րն է արտացոլում նորմալ վիճակը, իսկ ո՞րը՝ հուզված։
Լուծում.Ազոտի էլեկտրոնային բանաձևը 1s 2 s 2 2p 3 է, արտաքին էլեկտրոնների բանաձևը 2s 2 2p 3 է։ Ենթամակարդակ 2p-ը թերի է, քանի որ դրա վրա էլեկտրոնների թիվը վեցից պակաս է։ Հնարավոր տարբերակներ 2p ենթամակարդակի վրա երեք էլեկտրոնների բաշխումները ներկայացված են Նկ. 9.

Բրինձ. 9. Ազոտի ատոմում 2p ենթամակարդակի հնարավոր վիճակների էլեկտրոնային-գրաֆիկական դիագրամներ:
Սփինի առավելագույն (բացարձակ արժեքով) արժեքը (3/2) համապատասխանում է 1-ին և 2-րդ վիճակներին, հետևաբար, դրանք աղացած են, իսկ մնացածը հուզված են:
Օրինակ 3Որոշե՛ք քվանտային թվերը, որոնք որոշում են վանադիումի ատոմի վերջին էլեկտրոնի վիճակը:
Լուծում.Վանադիումի ատոմային թիվը Z = 23 է, հետևաբար տարրի լրիվ էլեկտրոնային բանաձևն է՝ 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 3։ Արտաքին էլեկտրոնների էլեկտրոնային գրաֆիկական սխեման (4s 2 3d 3) հետևյալն է (նկ. 10).
![]()
Բրինձ. 10. Վանադիումի ատոմի վալենտային էլեկտրոնների էլեկտրոն-գրաֆիկական սխեման
Վերջին էլեկտրոնի հիմնական քվանտային թիվը n = 3 (երրորդ էներգիայի մակարդակ), ուղեծրային լ= 2 (ենթամակարդակ դ): Երեք d-էլեկտրոններից յուրաքանչյուրի համար մագնիսական քվանտային թիվը տարբեր է. առաջինի համար այն -2 է, երկրորդի համար -1, երրորդի համար՝ 0։ Սպինի քվանտային թիվը բոլոր երեք էլեկտրոնների համար նույնն է՝ m s \u003d + 1/2. Այսպիսով, վանադիումի ատոմի վերջին էլեկտրոնի վիճակը բնութագրվում է քվանտային թվերով՝ n = 3; լ= 2; մ = 0; մ վ = + 1/2:
7. Զույգացված և չզույգացված էլեկտրոններ
Էլեկտրոնները, որոնք լրացնում են ուղեծրերը զույգերով, կոչվում են զուգավորված,իսկ մեկ էլեկտրոնները կոչվում են չզույգված. Չզույգված էլեկտրոնները ապահովում են ատոմի քիմիական կապը այլ ատոմների հետ: Չզույգված էլեկտրոնների առկայությունը հաստատվում է փորձարարական եղանակով՝ ուսումնասիրելով մագնիսական հատկությունները։ Չզույգված էլեկտրոններով նյութեր պարամագնիսական(նրանք ներքաշվում են մագնիսական դաշտի մեջ էլեկտրոնների սպինների փոխազդեցության պատճառով, ինչպես տարրական մագնիսները, արտաքինի հետ մագնիսական դաշտը) Նյութեր, որոնք ունեն միայն զուգակցված էլեկտրոններ դիամագնիսական(դրանց վրա արտաքին մագնիսական դաշտը չի գործում): Չզույգված էլեկտրոնները տեղակայված են միայն ատոմի արտաքին էներգիայի մակարդակի վրա, և դրանց թիվը կարելի է որոշել նրա էլեկտրոնային գրաֆիկական սխեմայից:
Օրինակ 4Որոշեք ծծմբի ատոմում չզույգված էլեկտրոնների թիվը:
Լուծում.Ծծմբի ատոմային թիվը Z = 16 է, հետևաբար տարրի ամբողջական էլեկտրոնային բանաձևն է՝ 1s 2 2s 2 2p 6 3s 2 3p 4։ Արտաքին էլեկտրոնների էլեկտրոնային գրաֆիկական սխեման հետևյալն է (նկ. 11).
![]()
Բրինձ. 11. Ծծմբի ատոմի վալենտային էլեկտրոնների էլեկտրոն-գրաֆիկական սխեման
Էլեկտրոն-գրաֆիկական սխեմայից հետևում է, որ ծծմբի ատոմում կա երկու չզույգված էլեկտրոն։

 sp հիբրիդացում -մեկ s ուղեծրը և մեկ p-ուղեծրը վերածվում են երկու նույնական «հիբրիդային» ուղեծրերի, որոնց առանցքների միջև անկյունը 180° է։ Մոլեկուլները, որոնցում տեղի է ունենում sp հիբրիդացում, ունեն գծային երկրաչափություն (BeCl 2):
sp հիբրիդացում -մեկ s ուղեծրը և մեկ p-ուղեծրը վերածվում են երկու նույնական «հիբրիդային» ուղեծրերի, որոնց առանցքների միջև անկյունը 180° է։ Մոլեկուլները, որոնցում տեղի է ունենում sp հիբրիդացում, ունեն գծային երկրաչափություն (BeCl 2):





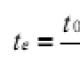



Գոյատևեն միայն սիրահարները
Երեխաներին ուղղված գովազդի առանձնահատկությունները
հին լուսանկարների ռետուշավորում photoshop-ում հին լուսանկարների ռետուշավորում
Ինչ է NPO. վերծանում, նպատակների սահմանում, գործունեության տեսակները Արդյո՞ք շահույթ չհետապնդող կազմակերպությունն իրավունք ունի.
Գլեբ Նիկիտինի առաջին տեղակալ