Algoritm pentru compilarea formulei electronice a unui element:
1. Determinați numărul de electroni dintr-un atom folosind Tabelul periodic al elementelor chimice D.I. Mendeleev.
2. După numărul perioadei în care se află elementul, determinați numărul de niveluri de energie; numărul de electroni din ultimul nivel electronic corespunde numărului de grup.
3. Împărțiți nivelurile în subnivele și orbitali și umpleți-le cu electroni în conformitate cu regulile de umplere a orbitalilor:
Trebuie reținut că primul nivel are maximum 2 electroni. 1s2, pe al doilea - maximum 8 (două sși șase R: 2s 2 2p 6), pe a treia - maximum 18 (două s, șase p, și zece d: 3s 2 3p 6 3d 10).
- Numărul cuantic principal n ar trebui să fie minimă.
- Completat primul s- subnivel, atunci p-, d-b f- subniveluri.
- Electronii umplu orbitalii în ordinea crescătoare a energiei orbitale (regula lui Klechkovsky).
- În cadrul subnivelului, electronii ocupă mai întâi orbitalii liberi pe rând și abia după aceea formează perechi (regula lui Hund).
- Nu pot exista mai mult de doi electroni într-un orbital (principiul Pauli).
Exemple.
1. Compuneți formula electronică a azotului. Azotul este numărul 7 în tabelul periodic.

2. Compuneți formula electronică a argonului. În tabelul periodic, argonul este la numărul 18.
1s 2 2s 2 2p 6 3s 2 3p 6.

3. Compuneți formula electronică a cromului. În tabelul periodic, cromul este numărul 24.
1s 2 2s 2 2p 6 3s 2 3p 6 4s 1 3d 5

Diagrama energetică a zincului.
4. Compuneți formula electronică a zincului. În tabelul periodic, zincul este numărul 30.
1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10
Rețineți că o parte a formulei electronice, și anume 1s 2 2s 2 2p 6 3s 2 3p 6 este formula electronică a argonului.
Formula electronică a zincului poate fi reprezentată ca.
2. Structura nucleelor și a învelișurilor de electroni ale atomilor
2.7. Distribuția electronilor într-un atom
Starea electronilor dintr-un atom este indicată folosind o notație specifică. De exemplu, pentru un atom de heliu avem:
Distribuția electronilor într-un atom este indicată prin:
A) circuite electronice, în care se notează doar numărul de electroni din fiecare strat. De exemplu: Mg 2e , 8e , 2e ; Cl2e, 8e, 7e.
Grafică folosită des circuite electronice, de exemplu, pentru atomul de clor:

b) configuratii electronice; în acest caz, sunt afișate numărul stratului (nivelului), natura subnivelurilor și numărul de electroni de pe acestea. De exemplu:
Mg 1s 2 2s 2 2p 6 3s 2 ;
în) scheme grafice electronice, pe care sunt reprezentați orbitalii, de exemplu, sub forma unei celule, iar electronii sunt reprezentați prin săgeți (Fig. 2.6).

Orez. 2.6. Schema grafică electronică pentru atomul de magneziu
Pe lângă formulele complete ale configurațiilor electronice, cele abreviate sunt utilizate pe scară largă. În acest caz, porțiunea de gaz nobil a configurației electronice este indicată prin simbolul gazului nobil între paranteze drepte. De exemplu: 12 Mg3s 2 , 19 K4s 1 .
Există anumite principii și reguli pentru umplerea nivelurilor și subnivelurilor de energie cu electroni:
1. Principiul energiei totale minime a unui atom, conform căruia populația AO cu electroni se produce în așa fel încât energia totală a atomului să fie minimă. Următoarea secvență de umplere cu AO a fost stabilită experimental:
1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p ... .
2. Un AO nu poate conține mai mult de doi electroni, iar în acest caz spinurile lor trebuie să fie antiparalele.
3. Într-un subnivel de energie dat, electronii umplu AO treptat, mai întâi unul câte unul (întâi toți cei vacante, și numai apoi doi), iar orientarea tuturor electronilor nepereche ar trebui să fie aceeași, adică. astfel de
dar nu așa
În aproape orice atom, numai s - și p -AO sunt externe (Fig. 2.7), așadar Stratul exterior de electroni al oricărui atom nu poate avea mai mult de opt electroni.. Un strat exterior de electroni care conține opt electroni (doi în cazul heliului) se numește complet.

Orez. 2.7. Scheme grafice electronice pentru atomii K (a) și S (b)
Configurații electronice ale atomilor elementelor din perioada a IV-a a sistemului periodicValorile energetice ale diferitelor subniveluri de energie pentru diferiți atomi nu sunt constante, dar depind de sarcina nucleului Z al unui atom element: pentru atomii elementelor cu Z = 1–20 Е 3 d > E 4 s și Е 3 d > E 4 p ; pentru atomii elementelor cu Z ≥ 21 invers: E 3 d< E 4 s и Е 3 d < E 4 p (рис. 2.8). Кроме того, чем больше Z , тем меньше различаются подуровни по энергии, а кривые, выражающие зависимость энергии подуровней от Z , пересекаются.

Orez. 2.8. Diagrama subnivelurilor energetice ale atomilor elementelor cu Z = 1–20 (a), Z ≥ 21 (b)
Configurațiile electronice ale atomilor (starea fundamentală) K și Ca sunt după cum urmează (vezi Fig. 2.8):
19 K: 1s 2 2s 2 2p 6 3s 2 3p 6 4s 1 ,
20 Ca: 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 .
Pornind de la scandiu (Z = 21), subnivelul 3d este umplut, iar electronii 4s rămân în stratul exterior. Formula electronică generală a atomilor elementelor de la Sc la Zn este 3d 1−10 4s 1−2. De exemplu:
21 Sc: 3d 1 4s 2 ,
25 Mn: 3d 5 4s 2 ,
28 Ni: 3d 8 4s 2 .
30 Zn: 3d 10 4s 2 .
Pentru crom și cupru se observă o alunecare (eșec) a electronului 4s la subnivelul 3d: Cr - 3d 5 4s 1, Cu - 3d 10 4s 1. Un astfel de salt de la subnivelul ns - la (n - 1)d - se observă și la atomii altor elemente (Mo, Ag, Au, Pt) și se explică prin apropierea energiilor ns - și (n). - 1)d -subnivelurile, precum și stabilitatea subnivelurilor d pe jumătate și complet umplute.
Mai departe, în a 4-a perioadă, după 10 d-elemente urmează de la Ga ( 3d 10 4s 2 4p 1) la Kr ( 3d 10 4s 2 4p 6) p-elemente.
Formarea cationilor elementelor d este asociată cu pierderea primului electron extern ns-, apoi (n - 1)d-electron, de exemplu:
Ti: 3d 2 4s 2 → − 2 e − Ti 2+ : 3d 2 → − 1 e − Ti 3+ : 3d 1
Mn: 3d 5 4s 2 → − 2 e − Mn 2+ : 3d 5 → − 2 e − Mn 4+ : 3d 3
Rețineți că în formulele configurațiilor electronice, se obișnuiește să scrieți mai întâi toți electronii cu o valoare mai mică de n, apoi să continuați să indicați electronii cu o valoare mai mare a numărului cuantic principal. Prin urmare, ordinea de umplere și ordinea de înregistrare a subnivelurilor de energie pentru elementele 3d nu se potrivesc. De exemplu, în formula electronică a atomului de scandiu, orbitalul 3d este indicat înaintea orbitalului 4s, deși orbitalul 4s este umplut mai devreme.
Apare o întrebare firească: de ce subnivelul 4s este umplut mai devreme în atomii elementelor 3d, deși energia sa este mai mare decât energia subnivelului 3d? De ce, de exemplu, atomul Sc nu are configurația electronică 1s 2 2s 2 2p 6 3s 2 3p 6 3d 3 în starea fundamentală?
Acest lucru se datorează faptului că raportul dintre energiile diferitelor stări electronice ale unui atom nu coincide întotdeauna cu raportul dintre energiile subnivelurilor individuale de energie. Energia subnivelului 4s pentru elementele 3d este mai mare decât energia subnivelului 3d, dar energia stării
3d 1 4s 2 este mai mică decât energia stării 3d 3 .
Acest lucru se explică prin faptul că repulsia interelectronică și, în consecință, energia întregii stări pentru configurația ... 3d 3 (cu trei electroni pe același subnivel de energie) este mai mare decât pentru configurația ... 3d 1 4s 2 (cu trei electroni, la diferite niveluri de energie).
Este scris sub forma așa-numitelor formule electronice. În formulele electronice, literele s, p, d, f indică subnivelurile energetice ale electronilor; numerele din fața literelor indică nivelul de energie în care se află electronul dat, iar indicele din dreapta sus este numărul de electroni din acest subnivel. Pentru a compune formula electronică a unui atom a oricărui element, este suficient să cunoașteți numărul acestui element în sistemul periodic și să îndepliniți prevederile de bază care guvernează distribuția electronilor într-un atom.
 Structura învelișului de electroni a unui atom poate fi descrisă și sub forma unui aranjament de electroni în celulele energetice.
Structura învelișului de electroni a unui atom poate fi descrisă și sub forma unui aranjament de electroni în celulele energetice.
Pentru atomii de fier, o astfel de schemă are următoarea formă:
Această diagramă arată clar implementarea regulii lui Hund. La subnivelul 3d suma maxima, celulele (patru) sunt umplute cu electroni nepereche. Imaginea structurii învelișului de electroni din atom sub formă de formule electronice și sub formă de diagrame nu reflectă în mod clar proprietățile de undă ale electronului.
Formularea legii periodice cu modificările ulterioare DA. Mendeleev : proprietățile corpurilor simple, precum și formele și proprietățile compușilor elementelor, sunt într-o dependență periodică de mărimea greutăților atomice ale elementelor.
Formularea modernă a Legii periodice: proprietățile elementelor, precum și formele și proprietățile compușilor lor, sunt într-o dependență periodică de mărimea sarcinii nucleului atomilor lor.
Astfel, sarcina pozitivă a nucleului (mai degrabă decât masa atomică) s-a dovedit a fi un argument mai precis de care depind proprietățile elementelor și compușilor acestora.
Valenţă- este numărul de legături chimice pe care un atom este legat de altul.
Posibilitățile de valență ale unui atom sunt determinate de numărul de electroni nepereche și de prezența orbitalilor atomici liberi la nivelul exterior. Structura nivelurilor exterioare de energie ale atomilor elementelor chimice determină în principal proprietățile atomilor lor. Prin urmare, aceste niveluri sunt numite niveluri de valență. Electronii acestor niveluri, și uneori ai nivelurilor pre-externe, pot lua parte la formarea legăturilor chimice. Astfel de electroni sunt numiți și electroni de valență.
Valența stoichiometrică element chimic - este numărul de echivalenți pe care un anumit atom îi poate atașa sau este numărul de echivalenți din atom.
Echivalenții sunt determinați de numărul de atomi de hidrogen atașați sau substituiți, prin urmare, valența stoechiometrică este egală cu numărul de atomi de hidrogen cu care acest atom interacționează. Dar nu toate elementele interacționează liber, dar aproape totul interacționează cu oxigenul, astfel încât valența stoechiometrică poate fi definită ca de două ori mai mare decât numărul de atomi de oxigen atașați.
De exemplu, valența stoechiometrică a sulfului în hidrogenul sulfurat H 2 S este 2, în oxidul SO 2 - 4, în oxidul SO 3 - 6.
Când se determină valența stoechiometrică a unui element conform formulei unui compus binar, trebuie să se ghideze după regula: valența totală a tuturor atomilor unui element trebuie să fie egală cu valența totală a tuturor atomilor altui element.
Stare de oxidare de asemenea caracterizează compoziția substanței și este egală cu valența stoechiometrică cu semnul plus (pentru un metal sau un element mai electropozitiv dintr-o moleculă) sau minus.
1. La substanțele simple, starea de oxidare a elementelor este zero.
2. Starea de oxidare a fluorului în toți compușii este -1. Halogenii rămași (clor, brom, iod) cu metale, hidrogen și alte elemente mai electropozitive au și ei o stare de oxidare de -1, dar în compușii cu elemente mai electronegative au stări de oxidare pozitive.
3. Oxigenul din compuși are o stare de oxidare de -2; excepțiile sunt peroxidul de hidrogen H 2 O 2 și derivații săi (Na 2 O 2, BaO 2 etc., în care oxigenul are o stare de oxidare de -1, precum și fluorura de oxigen OF 2, în care starea de oxidare a oxigenului este +2.
4. Elementele alcaline (Li, Na, K, etc.) și elementele subgrupei principale din a doua grupă a sistemului periodic (Be, Mg, Ca etc.) au întotdeauna o stare de oxidare egală cu numărul grupului, care este, +1 și, respectiv, +2.
5. Toate elementele grupei a treia, cu excepția taliului, au o stare de oxidare constantă egală cu numărul grupului, adică. +3.
6. Cea mai mare stare de oxidare a unui element este egală cu numărul de grup al sistemului periodic, iar cea mai mică este diferența: numărul de grup - 8. De exemplu, cel mai înalt grad oxidarea azotului (se află în grupa a cincea) este +5 (în acid azotic și sărurile sale), iar cea mai mică este -3 (în amoniac și săruri de amoniu).
7. Stările de oxidare ale elementelor din compus se compensează reciproc, astfel încât suma lor pentru toți atomii dintr-o moleculă sau o unitate de formulă neutră este zero, iar pentru un ion - sarcina acestuia.
Aceste reguli pot fi utilizate pentru a determina starea de oxidare necunoscută a unui element dintr-un compus, dacă stările de oxidare ale celorlalți sunt cunoscute și pentru a formula compuși multi-element.
Gradul de oxidare (numarul de oxidare,) — valoare condiționată auxiliară pentru înregistrarea proceselor de oxidare, reducere și reacții redox.
concept starea de oxidare folosit adesea în chimia anorganică în locul conceptului valenţă. Starea de oxidare a unui atom este egală cu valoarea numerică a sarcinii electrice atribuită atomului, presupunând că perechile de electroni care realizează legătura sunt complet polarizate către atomi mai electronegativi (adică pe baza presupunerii că compusul este format numai de ioni).
Starea de oxidare corespunde numărului de electroni care trebuie adăugați unui ion pozitiv pentru a-l reduce la un atom neutru sau luați dintr-un ion negativ pentru a-l oxida la un atom neutru:
Al 3+ + 3e − → Al
S 2− → S + 2e − (S 2− − 2e − → S)
Proprietățile elementelor, în funcție de structura învelișului electronic al atomului, se modifică în funcție de perioadele și grupele sistemului periodic. Deoarece într-un număr de elemente analoge structurile electronice sunt doar similare, dar nu identice, la trecerea de la un element dintr-un grup la altul, nu se observă o simplă repetare a proprietăților pentru ele, ci schimbarea regulată mai mult sau mai puțin clar exprimată a acestora.
Natura chimică a unui element este determinată de capacitatea atomului său de a pierde sau câștiga electroni. Această capacitate este cuantificată prin valorile energiilor de ionizare și ale afinității electronilor.
Energia de ionizare (Ei) este cantitatea minimă de energie necesară pentru detașarea și îndepărtarea completă a unui electron dintr-un atom în fază gazoasă la T = 0
K fără a transfera energie cinetică la electronul eliberat cu transformarea atomului într-un ion încărcat pozitiv: E + Ei = E + + e-. Energia de ionizare este o valoare pozitivă și are cele mai mici valori pentru atomii de metale alcaline și cea mai mare pentru atomii de gaz nobili (inerți).
Afinitatea electronică (Ee) este energia eliberată sau absorbită atunci când un electron este atașat de un atom în faza gazoasă la T = 0
K cu transformarea atomului într-un ion încărcat negativ fără a transfera energie cinetică particulei:
E + e- = E- + Ee.
Halogenii, în special fluorul, au afinitatea electronică maximă (Ee = -328 kJ/mol).
Valorile lui Ei și Ee sunt exprimate în kilojuli pe mol (kJ/mol) sau în electron volți per atom (eV).
Capacitatea unui atom legat de a deplasa electronii legăturilor chimice spre sine, crescând densitatea electronilor în jurul său se numește electronegativitatea.
Acest concept a fost introdus în știință de L. Pauling. Electronegativitateanotat cu simbolul ÷ și caracterizează tendința unui atom dat de a atașa electroni atunci când formează o legătură chimică.
Potrivit lui R. Maliken, electronegativitatea unui atom este estimată la jumătate din suma energiilor de ionizare și afinitatea electronică a atomilor liberi h = (Ee + Ei)/2
În perioade, există o tendință generală de creștere a energiei de ionizare și a electronegativității cu o creștere a sarcinii nucleului atomic; în grupuri, aceste valori scad odată cu creșterea numărului ordinal al elementului.
Trebuie subliniat faptul că unui element nu i se poate atribui o valoare constantă a electronegativității, deoarece aceasta depinde de mulți factori, în special de starea de valență a elementului, de tipul de compus în care este inclus, de numărul și tipul de vecinătate. atomi.
Raze atomice și ionice. Dimensiunile atomilor și ionilor sunt determinate de dimensiunile învelișului de electroni. Conform conceptelor mecanicii cuantice, învelișul de electroni nu are limite strict definite. Prin urmare, pentru raza unui atom sau ion liber, putem lua distanța calculată teoretic de la miez până la poziția densității maxime principale a norilor de electroni exteriori. Această distanță se numește raza orbitală. În practică, se folosesc de obicei valorile razelor atomilor și ionilor din compuși, calculate din date experimentale. În acest caz, se disting razele covalente și metalice ale atomilor.
Dependența razelor atomice și ionice de sarcina nucleului unui atom al unui element și este periodică. În perioade, pe măsură ce numărul atomic crește, razele tind să scadă. Cea mai mare scădere este tipică pentru elementele de perioade mici, deoarece nivelul electronic exterior este umplut în ele. În perioade mari în familiile de elemente d și f, această schimbare este mai puțin accentuată, deoarece umplerea electronilor în ele are loc în stratul preextern. În subgrupe, razele atomilor și ionilor de același tip cresc în general.
Sistemul periodic de elemente este un exemplu clar al manifestării diferitelor tipuri de periodicitate în proprietățile elementelor, care este observată orizontal (într-o perioadă de la stânga la dreapta), vertical (într-un grup, de exemplu, de sus în jos). ), în diagonală, adică o anumită proprietate a atomului crește sau scade, dar periodicitatea se păstrează.
În perioada de la stânga la dreapta (→), proprietățile oxidante și nemetalice ale elementelor cresc, în timp ce proprietățile reducătoare și metalice scad. Deci, dintre toate elementele din perioada 3, sodiul va fi cel mai activ metal și cel mai puternic agent reducător, iar clorul va fi cel mai puternic agent oxidant.
legătură chimică- aceasta este interconectarea atomilor într-o moleculă, sau rețea cristalină, ca rezultat al acțiunii forțelor electrice de atracție dintre atomi.
Aceasta este interacțiunea tuturor electronilor și a tuturor nucleelor, ducând la formarea unui sistem poliatomic stabil (radical, ion molecular, moleculă, cristal).
Legătura chimică este realizată de electroni de valență. Conform conceptelor moderne, legătura chimică are o natură electronică, dar se realizează în moduri diferite. Prin urmare, există trei tipuri principale de legături chimice: covalent, ionic, metalicÎntre molecule apare legătură de hidrogen,și se întâmplă interacțiunile van der Waals.
Principalele caracteristici ale unei legături chimice sunt:
- lungimea legăturii - este distanța internucleară dintre atomii legați chimic.
Depinde de natura atomilor care interacționează și de multiplicitatea legăturii. Cu o creștere a multiplicității, lungimea legăturii scade și, în consecință, rezistența acesteia crește;
- multiplicitatea legăturilor - este determinată de numărul de perechi de electroni care leagă doi atomi. Pe măsură ce multiplicitatea crește, energia de legare crește;
- unghi de conectare- unghiul dintre liniile drepte imaginare care trec prin nucleele a doi atomi vecini interconectați chimic;
Energie de legare E CB - aceasta este energia care este eliberată în timpul formării acestei legături și este cheltuită pentru a o rupe, kJ / mol.
legătură covalentă - O legătură chimică formată prin împărțirea unei perechi de electroni cu doi atomi.
Explicația legăturii chimice prin apariția perechilor de electroni comuni între atomi a stat la baza teoriei spin a valenței, al cărei instrument este metoda legăturii de valență (MVS) , descoperit de Lewis în 1916. Pentru descrierea mecanică cuantică a legăturii chimice și a structurii moleculelor se folosește o altă metodă - metoda orbitală moleculară (MMO) .
Metoda legăturii de valență
Principiile de bază ale formării unei legături chimice conform MVS:
1. Se formează o legătură chimică datorită electronilor de valență (nepereche).
2. Electronii cu spin antiparalel aparținând a doi atomi diferiți devin comuni.
3. O legătură chimică se formează numai dacă, atunci când doi sau mai mulți atomi se apropie unul de celălalt, energia totală a sistemului scade.
4. Principalele forte care actioneaza in molecula sunt de origine electrica, coulombiana.
5. Cu cât conexiunea este mai puternică, cu atât norii de electroni care interacționează se suprapun.
Există două mecanisme pentru formarea unei legături covalente:
mecanism de schimb. Legătura se formează prin împărțirea electronilor de valență a doi atomi neutri. Fiecare atom dă un electron nepereche unei perechi de electroni comune:
Orez. 7. Mecanism de schimb pentru formarea unei legături covalente: A- nepolar; b- polar
Mecanismul donor-acceptor. Un atom (donator) oferă o pereche de electroni, iar un alt atom (acceptor) oferă un orbital gol pentru această pereche.
conexiuni, educat conform mecanismului donor-acceptor, aparțin compuși complecși
 |
Orez. 8. Mecanismul donor-acceptor al formării legăturilor covalente
O legătură covalentă are anumite caracteristici.
Saturabilitatea - proprietatea atomilor de a forma un număr strict definit de legături covalente. Datorită saturației legăturilor, moleculele au o anumită compoziție.
|
Orientare - t . e. legătura se formează în direcţia de suprapunere maximă a norilor de electroni . În ceea ce privește linia care leagă centrele atomilor care formează o legătură, există: σ și π (Fig. 9): σ-legatură - formată prin suprapunerea AO de-a lungul liniei care leagă centrele atomilor care interacționează; O legătură π este o legătură care are loc în direcția unei axe perpendiculare pe linia dreaptă care leagă nucleele unui atom. Orientarea legăturii determină structura spațială a moleculelor, adică forma lor geometrică. hibridizare - este o modificare a formei unor orbitali în formarea unei legături covalente pentru a realiza o suprapunere mai eficientă a orbitalilor. Legătura chimică formată cu participarea electronilor orbitalilor hibrizi este mai puternică decât legătura cu participarea electronilor orbitalilor s și p nehibrizi, deoarece există mai multă suprapunere. Există următoarele tipuri de hibridizare (Fig. 10, Tabelul 31): |
hibridizare sp 2- un orbital s și doi orbitali p se transformă în trei orbitali „hibrizi” identici, al căror unghi dintre axe este de 120°. Moleculele în care se realizează hibridizarea sp2 au o geometrie plată (BF3, AlCl3).
sp 3-hibridizare- un orbital s și trei orbitali p se transformă în patru orbitali „hibrizi” identici, al căror unghi dintre axe este de 109 ° 28". Moleculele în care are loc hibridizarea sp 3 au o geometrie tetraedrică (CH 4 ). , NH3).



Orez. 10. Tipuri de hibridizări ale orbitalilor de valență: a - sp-hibridarea orbitalilor de valență; b - sp2- hibridizarea orbitalilor de valență; în - sp 3 - hibridizarea orbitalilor de valență
Structura învelișurilor de electroni ale atomilor joacă un rol important în chimie, determină proprietățile chimice ale substanțelor. Cea mai importantă caracteristică a mișcării unui electron pe o anumită orbită este energia conexiunii acestuia cu nucleul. Electronii dintr-un atom diferă într-o anumită energie și, după cum arată experimentele, unii sunt atrași de nucleu mai puternic, alții mai slab. Acest lucru se explică prin îndepărtarea electronilor de nucleu. Cu cât electronii sunt mai aproape de nucleu, cu atât legătura lor cu nucleul este mai mare, dar cu atât mai puțină energie. Pe măsură ce distanța de la nucleul atomului, forța de atracție a electronului către nucleu scade, iar aprovizionarea cu energie crește. Așa se formează straturile de electroni în învelișul de electroni a unui atom. Electronii cu valori energetice similare formează un singur strat de electroni, sau nivel de energie. Energia electronilor dintr-un atom și nivelul de energie sunt determinate de numărul cuantic principal n și iau valori întregi 1, 2, 3, 4, 5, 6 și 7. Cu cât valoarea lui n este mai mare, cu atât energia este mai mare. a electronului din atom. Numărul maxim de electroni care pot fi într-un anumit nivel de energie este determinat de formula:
Unde N este numărul maxim de electroni pe nivel;
n este numărul nivelului de energie.
S-a stabilit că nu mai mult de doi electroni sunt localizați pe primul înveliș, nu mai mult de opt pe a doua, nu mai mult de 18 pe a treia și nu mai mult de 32 pe a patra. Nu vom lua în considerare umplerea a mai multor. scoici îndepărtate. Se știe că nivelul de energie externă nu poate conține mai mult de opt electroni, se numește complet. Straturile electronice care nu conțin numărul maxim de electroni sunt numite incomplete.
Numărul de electroni din nivelul energetic exterior al învelișului de electroni a unui atom este egal cu numărul de grup pentru elementele chimice ale subgrupurilor principale.
După cum sa menționat anterior, electronul nu se mișcă pe o orbită, ci pe o orbită și nu are traiectorie.
Spațiul din jurul nucleului unde este cel mai probabil să fie un anumit electron se numește orbital electronului respectiv sau nor de electroni.
Orbitalii sau subnivelurile, după cum sunt numite și ele, pot avea forme diferite, iar numărul lor corespunde numărului nivelului, dar nu depășește patru. Primul nivel de energie are un subnivel (s), al doilea are două (s,p), al treilea are trei (s,p,d) și așa mai departe. Electronii de diferite subnivele ale aceluiași nivel au forme diferite ale norului de electroni: sferici (s), în formă de gantere (p) și configurații mai complexe (d) și (f). Oamenii de știință au fost de acord să numească orbital atomic sferic s-orbital. Este cel mai stabil și este situat destul de aproape de miez.
Cu cât energia unui electron într-un atom este mai mare, cu atât se rotește mai repede, cu atât regiunea de ședere este mai extinsă și, în cele din urmă, se transformă într-o formă de gantere. p-orbital:
Un nor de electroni de această formă poate ocupa trei poziții într-un atom de-a lungul axelor de coordonate ale spațiului X, yși z. Acest lucru este ușor de explicat: la urma urmei, toți electronii sunt încărcați negativ, astfel încât norii de electroni se resping reciproc și tind să fie amplasați cât mai departe unul de celălalt.
Asa de, p Pot exista trei orbitali. Energia lor, desigur, este aceeași, dar locația lor în spațiu este diferită.
Desenați o diagramă a umplerii secvențiale a nivelurilor de energie cu electroni
Acum putem întocmi o diagramă a structurii învelișurilor de electroni ale atomilor:
1. Determinați numărul total de electroni de pe înveliș după numărul de serie al elementului.
2. Determinați numărul de niveluri de energie din învelișul de electroni. Numărul lor este egal cu numărul perioadei din tabelul lui D. I. Mendeleev, în care se află elementul.
3. Determinați numărul de electroni la fiecare nivel de energie.
4. Folosirea cifrelor arabe pentru a desemna nivelul și desemnarea orbitalilor cu literele s și p și a numărului de electroni dintr-un orbital dat Cifra arabăîn dreapta sus, deasupra literei, descriem structura atomilor cu formule electronice mai complete. Oamenii de știință au convenit să desemneze fiecare orbital atomic ca o celulă cuantică - un pătrat pe diagrama energetică:
Pe s Un subnivel poate conține un orbital atomic
și pe p-s-ar putea să existe deja trei subniveluri -
(după cele trei axe de coordonate):
Orbitali d- și f- subnivelurile dintr-un atom pot fi deja cinci și, respectiv, șapte:
Nucleul unui atom de hidrogen are o sarcină de +1, deci doar un electron se mișcă în jurul nucleului său la un singur nivel de energie. Să notăm configurația electronică a atomului de hidrogen
Pentru a stabili o legătură între structura atomului unui element chimic și proprietățile acestuia, vom lua în considerare încă câteva elemente chimice.
Următorul element după hidrogen este heliul. Nucleul unui atom de heliu are o sarcină de +2, deci un atom de heliu conține doi electroni în primul nivel de energie:
Deoarece primul nivel de energie nu poate conține mai mult de doi electroni, este considerat complet.
Elementul numărul 3 - litiu. Nucleul de litiu are o sarcină de +3, prin urmare, există trei electroni în atomul de litiu. Două dintre ele sunt la primul nivel de energie, iar al treilea electron începe să umple al doilea nivel de energie. Mai întâi, orbitalul s al primului nivel este umplut, apoi orbitalul s al celui de-al doilea nivel. Electronul din al doilea nivel este mai slab legat de nucleu decât ceilalți doi.
Pentru atomul de carbon, putem presupune deja trei scheme posibile umplerea învelișurilor de electroni în conformitate cu formulele electrografice:
O analiză a spectrului atomic arată că ultima schemă este corectă. Folosind această regulă, nu este dificil să se întocmească o diagramă a structurii electronice a atomului de azot:
Această schemă corespunde formulei 1s22s22p3. Apoi începe plasarea pe perechi a electronilor în orbitali 2p. Formule electronice ale atomilor rămași din a doua perioadă:
Umplerea celui de-al doilea nivel de energie al atomului de neon se încheie, iar construcția celei de-a doua perioade a sistemului de elemente este finalizată.
Găsiți semnul chimic al litiului în sistemul periodic, de la litiu la neon Ne, sarcina nucleelor atomice crește în mod natural. Al doilea strat este umplut treptat cu electroni. Odată cu creșterea numărului de electroni din al doilea strat, proprietățile metalice ale elementelor slăbesc treptat și sunt înlocuite cu altele nemetalice.
A treia perioadă, ca și a doua, începe cu două elemente (Na, Mg), în care electronii sunt localizați la subnivelul s al stratului exterior de electroni. Aceasta este urmată de șase elemente (de la Al la Ar), în care se formează subnivelul p al stratului exterior de electroni. Structura stratului electronic exterior al elementelor corespunzătoare din a doua și a treia perioadă este similară. Cu alte cuvinte, cu o creștere a încărcăturii nucleului, structura electronică a straturilor exterioare ale atomilor se repetă periodic. Dacă elementele au aceleași niveluri de energie externă, atunci proprietățile acestor elemente sunt similare. De exemplu, argonul și neonul conțin opt electroni la nivelul exterior și, prin urmare, sunt inerți, adică aproape că nu intră în reacții chimice. În formă liberă, argonul și neonul sunt gaze care au molecule monoatomice.
Atomii de litiu, sodiu și potasiu conțin un electron la nivelul exterior și au proprietăți similare, deci sunt plasați în aceeași grupă a sistemului periodic.
III. Concluzii.
1. Proprietățile elementelor chimice, dispuse în ordinea crescătoare a sarcinii nucleare, se repetă periodic, întrucât structura nivelurilor de energie exterioară a atomilor elementelor se repetă periodic.
2. O schimbare lină a proprietăților elementelor chimice într-o perioadă poate fi explicată printr-o creștere treptată a numărului de electroni la nivelul energiei externe.
3. Motivul asemănării proprietăților elementelor chimice aparținând aceleiași familii constă în aceeași structură a nivelurilor energetice externe ale atomilor lor.
Structura electronică a unui atom poate fi prezentată printr-o formulă electronică și o diagramă grafică electronică. În formulele electronice, nivelurile și subnivelurile de energie sunt scrise succesiv în ordinea umplerii lor și a numărului total de electroni din subnivel. În acest caz, starea unui electron individual, în special numerele sale magnetice și cuantice de spin, nu se reflectă în formula electronică. În schemele grafice electronice, fiecare electron este complet „vizibil”, adică. poate fi caracterizat prin toate cele patru numere cuantice. Diagramele grafice electronice sunt de obicei date pentru electronii externi.
Exemplul 1 Scrieți formula electronică a fluorului, exprimați starea electronilor externi cu o diagramă grafică electronică. Câți electroni nepereche sunt într-un atom al acestui element?
Soluţie. Numărul atomic al fluorului este nouă, deci există nouă electroni în atomul său. În conformitate cu principiul energiei minime, folosind Fig. 7 și ținând cont de consecințele principiului Pauli, notăm formula electronică a fluorului: 1s 2 2s 2 2p 5 . Pentru electronii externi (al doilea nivel de energie), întocmim o diagramă grafică electronică (Fig. 8), din care rezultă că există un electron nepereche în atomul de fluor.
Orez. 8. Schema electron-grafică a electronilor de valență ai unui atom de fluor
Exemplul 2 Realizați diagrame electronic-grafice ale stărilor posibile ale atomului de azot. Care dintre ele reflectă starea normală și care - entuziasmată?
Soluţie. Formula electronică a azotului este 1s 2 s 2 2p 3 , formula electronilor externi este 2s 2 2p 3 . Subnivelul 2p este incomplet, deoarece numărul de electroni de pe el este mai mic de șase. Opțiuni posibile distribuțiile a trei electroni pe subnivelul 2p sunt prezentate în Fig. 9.

Orez. 9. Diagrame electron-grafice ale stărilor posibile ale subnivelului 2p în atomul de azot.
Valoarea maximă (în valoare absolută) a spinului (3 / 2) corespunde stărilor 1 și 2, prin urmare, acestea sunt măcinate, iar restul sunt excitate.
Exemplul 3 Determinați numerele cuantice care determină starea ultimului electron dintr-un atom de vanadiu?
Soluţie. Numărul atomic al vanadiului este Z = 23, prin urmare, formula electronică completă a elementului este: 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 3. Schema grafică electronică a electronilor externi (4s 2 3d 3) este următoarea (Fig. 10):
![]()
Orez. 10. Schema electron-grafică a electronilor de valență ai atomului de vanadiu
Numărul cuantic principal al ultimului electron n = 3 (al treilea nivel energetic), orbital l= 2 (subnivel d). Numărul cuantic magnetic pentru fiecare dintre cei trei electroni d este diferit: pentru primul este -2, pentru al doilea -1, pentru al treilea - 0. Numărul cuantic de spin pentru toți cei trei electroni este același: m s \u003d + 1/2. Astfel, starea ultimului electron din atomul de vanadiu se caracterizează prin numere cuantice: n = 3; l= 2; m = 0; m s = + 1 / 2 .
7. Electroni perechi și neperechi
Electronii care umplu orbitalii în perechi se numesc pereche, iar electronii unici se numesc nepereche. Electronii nepereche asigură legătura chimică a unui atom cu alți atomi. Prezența electronilor nepereche este stabilită experimental prin studierea proprietăților magnetice. Substanțe cu electroni nepereche paramagnetic(sunt atrași într-un câmp magnetic datorită interacțiunii spinurilor electronilor, ca magneții elementari, cu un camp magnetic). Substanțe care au doar electroni perechi diamagnetic(câmpul magnetic extern nu acționează asupra lor). Electronii nepereche sunt localizați numai la nivelul de energie exterior al unui atom și numărul lor poate fi determinat din schema sa grafică electronică.
Exemplul 4 Determinați numărul de electroni nepereche dintr-un atom de sulf.
Soluţie. Numărul atomic al sulfului este Z = 16, prin urmare, formula electronică completă a elementului este: 1s 2 2s 2 2p 6 3s 2 3p 4. Schema grafică electronică a electronilor externi este următoarea (Fig. 11).
![]()
Orez. 11. Schema electron-grafică a electronilor de valență ai unui atom de sulf
Din schema electron-grafică rezultă că în atomul de sulf există doi electroni nepereche.

 hibridizare sp - un orbital s și un orbital p se transformă în doi orbitali „hibrizi” identici, al căror unghi dintre axe este de 180°. Moleculele în care are loc hibridizarea sp au o geometrie liniară (BeCl 2).
hibridizare sp - un orbital s și un orbital p se transformă în doi orbitali „hibrizi” identici, al căror unghi dintre axe este de 180°. Moleculele în care are loc hibridizarea sp au o geometrie liniară (BeCl 2).





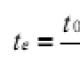


Pentru începători: creșterea unui pui de carne acasă Apă fiartă pentru pui de carne
Doar îndrăgostiții vor supraviețui
Caracteristici ale reclamei destinate copiilor
retuşarea fotografiilor vechi în photoshop retuşarea fotografiilor vechi
Ce este un NPO: decodare, definirea scopurilor, tipuri de activități Are o organizație non-profit dreptul